Kinh Nghiệm về Plaque assay là gì Chi Tiết
Bạn đang tìm kiếm từ khóa Plaque assay là gì được Update vào lúc : 2022-02-21 18:55:04 . Với phương châm chia sẻ Bí kíp về trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi tìm hiểu thêm Post vẫn ko hiểu thì hoàn toàn có thể lại phản hồi ở cuối bài để Tác giả lý giải và hướng dẫn lại nha.
1. Phương pháp phân lập vi trùng
Phân lập là khâu quan trọng trọng trong quy trình nghiên cứu và phân tích vi trùng. Mục đích của phân lập là tách riêng những vi trùng từ quần thể ban đầu tạo thành những clon thuần khiết để khảo sát và định loại. Khi vi trùng tăng trưởng và tăng trưởng trên mặt phẳng môi trường tự nhiên vạn vật thiên nhiên rắn đã tạo ra những khuẩn lạc, hình thái của những khuẩn lạc mang tính chất chất đặc trưng của từng loài vi trùng. Việc mô tả đúng chuẩn những khuẩn lạc đã tách rời hoàn toàn có thể góp thêm phần rất quan trọng trong việc định danh vi trùng. Các nhà vi trùng học đã tiêu chuẩn hoá có ý nghĩa khi miêu tả hình dáng, độ cao và bờ, rìa của khuẩn lạc.
Điều quan trọng trong quy trình nuôi cấy vi sinh vật là tránh không đưa thêm vi sinh vật ngoại nhiễm vào môi trường tự nhiên vạn vật thiên nhiên nuôi cấy. Muốn vậy, ngoài những thao tác luôn phải được tiến hành trong Đk vô trùng, mọi yếu tố từ môi trường tự nhiên vạn vật thiên nhiên, dụng cụ chứa, dụng cụ nuôi cấy đến những vật dụng thiết yếu khác đều phải được khử trùng thích hợp để được vô trùng trước lúc sử dụng.
1.1. Các dạng mẫu cho nuôi cấy
-Dạng dịch mẫu đã được giống hệt, dịch nuôi cấy hoặc môi trường tự nhiên vạn vật thiên nhiên lỏng chứa chủng vi sinh vật cần phântích.
-Dạng trên mặt phẳng môi trường tự nhiên vạn vật thiên nhiên rắn chứa thạch (1,5-2%) trong ống thạch nghiêng hay trong đĩa petri.
-Dạngmẫu nằm sâu trong môi trường tự nhiên vạn vật thiên nhiên rắn trong ống nghiệm thạch sâu chứa thạch mềm (0,5-0,7%).
1.2. Dụng cụ cấy
-Que cấy thẳng: Que cấy sắt kẽm kim loại có đầu nhọn, thường dùng để cấy vi trùng có tạo khuẩnty.
-Que cấy móc: que cấy có đầu vuông góc, thường dùng để cấy vi trùng có tạo khuẩnty.
-Que cấy vòng (Que khuyên cấy): que cấy sắt kẽm kim loại đầu có vòng tròn, thường dùng cấy chủng từ môi trường tự nhiên vạn vật thiên nhiên rắn hoặc lỏng lên môitrường rắn, lỏng.
-Que cấy trang:bằng sắt kẽm kim loại hay thủy tinh, đầu hình tam giác, dùng để giàn trải vi trùng trên mặt phẳng thạch rắn.
-Ống hút thủy tinh dùng để chuyển một lượng vi trùng nhất định lên mặt phẳng môi trường tự nhiên vạn vật thiên nhiên rắn hoặc vào môi trườnglỏng. Hiện nay, pipet cấy chuyển với những đầu tip vô trùng hoàn toàn có thể tháo rờiđể thay đổi (còn gọi là pipet đầu rời hay transfer pipet dạng hút thông thường).
– Đầu tăm bông vô trùng để cấy giống từ môi trường tự nhiên vạn vật thiên nhiên lỏng lên mặt phẳng của môi trường tự nhiên vạn vật thiên nhiên rắn.
1.3. Các thao tác vô trùng
Thao tác cấy được thực thi trong một không khí vô trùng tạo bởi ngọn lửa đèn cồn hoặc đèn Bunsen. Ngọn lửa đèn cồn, đèn Bunsen có tác dụng oxy hóa không khí tạo không khí vô trùng, đồng thời còn được sử dụng để đốt khử trùng que cấy, miệng chai lọ, ống nghiệm khi mở, đóng, nút bông, nắp nhựa
Để tránh việc gây nhiễm thông qua tiếp xúc, nhân viên cấp dưới thao tác cần mang găng tay hoặc tiến hành sát trùng tay bằng cồn 70ohoặc những dung dịch diệt khuẩn, tương tự như vậy tiến hành sát trùng mặt bàn thao tác trước lúc khởi đầu thao tác vô trùng. Sau khi hoàn tất việc cấy chủng, tiến hành sát trùng tay, mặt bàn thao tác tương tự như trên trước lúc rời phòng kiểm nghiệm.
1.4. Kỹ thuật cấy ria trên đĩa petri
-Dùng que cấy vòng thao tác vô trùng nhúng vào dịch mẫu để đã có được những vi trùng cần phân lập.
-Ria cácđường trên đĩa petri chứa môi trường tự nhiên vạn vật thiên nhiên thạch thích hợp. Sau mỗi đường ria liên tục, đốt khử trùng que cấy và làm nguộitrước khithực hiện đường ria tiếp theo.
-Lật ngược đĩa, ủ ở nhiệt độ và thời hạn thích hợp trongtủ ấm.
1.5. Kỹ thuật cấy trang
-Dùng pipet chuyển 0,1mldịch canhkhuẩn lên mặt phẳng môi trường tự nhiên vạn vật thiên nhiên thạch trongđĩa pettri.
-Nhúng đầu thanh gạt vào cồn, hơ qua ngọn lửa để khử trùng. Để đầu thanh gạt nguội trong không khí vô trùng của ngọn lửa.
-Mở đĩa petri, đật nhẹ nhàng thanh gạt lên mặt phẳng thạch của đĩa petri. Dùng đầu thanh gạt trải đều dịch vi trùng lên mặt phẳng thạch. Trong khi thực thi xoay đĩa một vài lần, mỗi lần khoảng chừng nửa chu vi đĩa tạo Đk cho thanh gạt trải dịch vi trùng đều khắp mặt phẳng môi trường tự nhiên vạn vật thiên nhiên.
-Lật ngược đĩa, ủ ở nhiệt độ và thời hạn thích hợp trong tủ ổn nhiệt.
2. Cấy chuyển
2.1. Cấy giống từ môi trường tự nhiên vạn vật thiên nhiên lỏng sang ống nghiệm chứa môi trường tự nhiên vạn vật thiên nhiên lỏng
-Đốt nóng đỏ đầu que cấy trong ngọn lửa và hơ nhẹ phần cán (phần sẽ đưa vào bên trong dụng cụ chứa vi sinh vật). Cầm thẳng đứng que cấy cho que cấy nóng đều.
-Tay trái cầm ống nghiệm xoay nhẹ, tay phải cầm que cấy. Ngón út của tay phải dùng để mở nút bông.
-Mở nút bông xoay miệng ống nghiệm qua ngọnlửa.
-Đưa que cấy đã khử trùng vào bên trong ống nghiệm, làm nguội que cấy bằng phương pháp áp đầu que cấy vào thành ống cho nguội. Thu sinh khối bằng phương pháp nhúng que cấy vào môi trường tự nhiên vạn vật thiên nhiên lỏng, rút thẳng que cấy ra không để dính vào thành và miệng ống. Hơ nóng miệng ống nghiệm, đậy nút bông. Đặt ống nghiệm vào giá đỡ.
-Đầu que cấy có chứa vi trùng được giữ ở vùng không khí vô trùng gần ngọn đèn. Dùng tay trái lấy ống nghiệm chứa môi trường tự nhiên vạn vật thiên nhiên mới, mở nút bông, khử trùng miệng ống nghiệm rồi đưa đầu que cấy vào bên trong môi trường tự nhiên vạn vật thiên nhiên.
-Nhúng và khuấy nhẹ que cấy trong dịch môi trường tự nhiên vạn vật thiên nhiên để tách sinh khối thoát khỏi đầu quecấy.
-Rút thẳng đầu que cấy ra. Khử trùng miệng ống nghiệm, đậy nút bông lại.
-Khử trùng que cấy ngay sau khi cấy xong.
2.2. Cấy giống từ môi trường tự nhiên vạn vật thiên nhiên lỏng sang ống thạch nghiêng
Tiến hành tương tự như trên với một số trong những khác lạ sau: cấy giống lên mặt phẳng thạch nghiêng bằng phương pháp đặt nhẹ đầu que cấy lên mặt phẳng môi trường tự nhiên vạn vật thiên nhiên ở đáy ống, tiếp theo đó cấy theo như hình chữ chi từ đáy ống nghiệm lên đến mức đầu trên của mặt thạch nghiêng.
2.3. Cấy giống từ môi trường tự nhiên vạn vật thiên nhiên lỏng bằng pipet đầu rời
Pipet đầu rời được cho phép thao tác đúng chuẩn với những dung tích nhỏ. Trong thao tác vô trùng, pipet đầu rời rất hữu dụng vì được cho phép cấy chuyển thuận tiện và đơn thuần và giản dị dịch vi trùng lên mặt phẳng môi trường tự nhiên vạn vật thiên nhiên rắn trong đĩa petri nhằm mục đích tạo khuẩn lạc rời hoặc vào ống nghiệm hay bình chứa môi trường tự nhiên vạn vật thiên nhiên lỏng để nuôi tăng sinh. Bằng một pipet đầu rời người ta hoàn toàn có thể thực thi với số lần không hạn chế những thao tác vô trùng này do hoàn toàn có thể hấp khử trùng hàng loạt với số lượng lớn những đầu tip. Trước khi sử dụng, kiểm nghiệm viên nên phải ghi nhận những yêu cầu cơ bản khi thao tác với pipet đầu rời như sau:
-Mỗi pipetđầu rời đều phải có số lượng giới hạn dung tích thao tác được cho phép nhất định. Thông thường những dải dung tíchđó là: 0,1ml,1- 20ml, 20- 200ml, 0,2- 1 ml, 1-5 ml, 1-10ml.Dải dungtích thao tác được cho phép này thường được ghi rõ trên pipet đầu rời. Trong dải dung tích được cho phép,kiểm nghiệm viên hoàn toàn có thể kiểm soát và điều chỉnh để sở hữu dung tích đúng chuẩn cần thao tác. Cần chọn pipet đầu rời với số lượng giới hạn dung tíchthích hợp cho phạm vi thao tác. Mỗiloại pipet đầu rời đều phải có đầu tip tương ứng và có thểđược khử trùng bằng nồihấpáp suất.
-Pipet đầu rời thường có hai nấc: nấc 1 tương tự với dung tích được chọn sử dụng khi hút dung dịch, nấc 2 vượt quá nấc 1 được sử dụng khi bơm dung dịch thoát khỏi đầu tip của pipet đầu rời.
-Khi sử dụng pipet đầu rời để cấy chuyển dời giống cần tiến hành thao tác trong không khí vô trùng của ngọn lửa trong tủ cấy.
-Tay phải cần pipet đầu rời, tay trái mở hộp chứa đầu tip vô trùng. Cắm đầu pipet vào đầu tip.
-Dùng tay trái giữ ống nghiệm, bình chứa dịch giống vi sinh vật. Dùng ngón út và áp út của tay phải đang giữ pipet để kẹp giữ và mở nút bông, hơ nóng khử trùng miệng ống nghiệm hoặc bình chứa.
-Đưa đầu tip vô trùng vào bên trong dịch giống, hút lấy dung tích thiết yếu.
-Rút đầu tip thoát khỏi miệng bình chứa, khử trùng miệng bình chứa và đậy bằng nút bông đang rất được giữ ở ngón út và áp út của tay phải.
-Đầu tip có chứa vi sinh vật được giữ ở vùng không khí vô trùng gần ngọn đèn.
-Dùng tay trái lấy ống nghiệm hoặc bình chứa môi trường tự nhiên vạn vật thiên nhiên mới, dùng ngón út và áp út kẹp và mở nút bông, khử trùng miệng bình chứa.
-Đưa đầu tip vào bên trong môi trường tự nhiên vạn vật thiên nhiên và bơm dịch giống vào môi trường tự nhiên vạn vật thiên nhiên.
-Rút đầu tip thoát khỏi miệng bình chứa, khử trùng miệng bình, đậy nút bông.
-Thay đầu tip vô trùngmới khi thực hiệnđợtcấy tiếp theo.
-Thực hiện tươngtự trong trường hợp cấy chuyển dời giống lênbềmặt môi trường tự nhiên vạn vật thiên nhiên trongđĩapetri.
-Cần lưu ý đầu pipet đầu rời và đầu tip được sản xuất bằng polymer nên tuyệt đối khử trùng đầu pipet và đầu tip bằng ngọn lửa.
Để đảm bảo sự tăng trưởng của vi trùng, sau khi cấy xong phải quan tâm đến những Đk môi trường tự nhiên vạn vật thiên nhiên nuôi vi trùng gồm có: (1) Nhiệt độ, phải chọn nhiệt độ tối ưu cho việc tăng trưởng của mỗi loài vi trùng và duy trì ổn định nhiệt độ đó; (2) Độ ẩm, để duy trì nhiệt độ trong quy trình nuôi ủ, cần đảm bảo đủ lượng nước khi làm môi trường tự nhiên vạn vật thiên nhiên. (3) Khí oxy riêng với vi sinh vật hiếu khí, lớp môi trường tự nhiên vạn vật thiên nhiên nuôi cấy có độ dày vừa phải để oxy không khí hoàn toàn có thể thấm vào.
3. Quy trình nhân giống và dữ gìn và bảo vệ chủng vi sinh vật chuẩn
3.1. Nguồn gốc
Chủng chuẩn phục vụ cho phòng thí nghiệm phải có nguồn gốc từ những nhà phục vụ hay tổ chức triển khai phục vụ giống vi trùng có uy tín, có hiệu suất cao phục vụ chủng giống vi trùng.
Giống được phục vụ phải đảm bảo yêu cầu về chất lượng, hoạt tính, có thông tin về những điểm lưu ý về sinh hóa, tính chất kháng nguyên.
Khi được nhà phục vụ chuyển đến phòng thí nghiệm những ống chủng vi trùng phải có nhãn ghi khá đầy đủ tên, mã số, ký hiệu chủng loại kèm theo phía dẫn dữ gìn và bảo vệ, số lần cấy chuyền (số thế hệ) và những điểm lưu ý sinh hóa, kháng nguyên.
3.2. Nhân giống và dữ gìn và bảo vệ
Chủng giống dạng đông khô từ những ngân hàng nhà nước giống sẽ là giống gốc. Từ đây chủng được nhân lên trong môi trường tự nhiên vạn vật thiên nhiên canh thang (lần cấy chuyền thứ nhất).
Vi sinh vật từ môi trường tự nhiên vạn vật thiên nhiên canh thang được cấy chuyển vào môi trường tự nhiên vạn vật thiên nhiên thạch dinh dưỡng Tryptose Soy Agar (TSA 1 đĩa và 15 ống thạch nghiêng) và môi trường tự nhiên vạn vật thiên nhiên tinh lọc.
-Môi trường thạch không tinh lọc:ủ ở 370C 24 giờ, kiểm tra độ thuần chủng trên đĩa TSA. Số lượng ống chủng tùy từng nhu yếu của phòng. Kiểm tra lại và vô hiệu những ống củng không đạt yêu cầu. Bảo quản những ống chủng ở 40C, thời hạn dữ gìn và bảo vệ tối đa là 3 tháng. Các chủng này được sử dụng làm đối chứng trong mọi lần phân tích mẫu.
– Môi trường thạch tinh lọc:cấy chủng từ môi trường tự nhiên vạn vật thiên nhiên canh thang trên lên môi trường tự nhiên vạn vật thiên nhiên thạch tinh lọc. Sau khi ủ, chọn một số trong những khuẩn lạc để kiểm tra lại mức độ thuần khiết, những đặc tính sinh hóa và đặc tính kháng nguyên.
Khi ống chủng sắp hết thời hạn dữ gìn và bảo vệ cho một lần cấy chuyển, những chủng giống được nhân lên trong môi trường tự nhiên vạn vật thiên nhiên canh thang dinh dưỡng và cấy chuyền vào những ống thạch nghiêng để dữ gìn và bảo vệ tương tự như trên.
Với một chủng vi trùng chuẩn chỉ được cấy tối đa 5 lần Tính từ lúc lần nhân giống thứ nhất. Sau mỗi lần cấy chuyển đều phải kiểm tra lại hoạt tính và độ thuần chủng. Khi hết thời hạn cấy chuyển phải thay chủng giống mới.
3.4. Sử dụng chủng chuẩn trong phân tích mẫu
Các chủng chuẩn trong môi trường tự nhiên vạn vật thiên nhiên thạch nghiêng trước lúc sử dụng làm mẫu chứng dương được cấy sang môi trường tự nhiên vạn vật thiên nhiên thạch đĩa không tinh lọc (Plate Count Agar, Tryptose Soy Agar hay Nutrien Agar) nhằm mục đích kiểm tra độ thuần khiết, những đĩa này được dữ gìn và bảo vệ và sử dụng trong một tuần.
3.5. Chú ý khi sử dụng chủng chuẩn
Các chủng chuẩn phải được sử dụng và dữ gìn và bảo vệ thận trọng ở 40C, mỗi ống chủng phải có nhãn mác ghi những thông tin như: tên, ký hiệu chủng, ngày, số lần cấy chuyển
Kiểm nghiệm viên phải thận trọng và tuân thủ những quy định về bảo vệ an toàn và uy tín phòng kiểm nghiệm khi cấy chuyển thao tác với những chủng chuẩn để tránh nhiễm bệnh hay làm lây lan mầm bệnh.
Dụng cụ sau khi tiếp xúc với những chủng vi trùng phải đựơc thanh trùng thận trọng. Dụng cụ thủy tinh và những đĩa petri sau khi sử dụng phải được hấp khử trùng ở 121oC 20 phút trước lúc đem rửa, dụng cụ thủy tinh được ngâm trong dung dịch chlorin, tiếp theo đó rửa bằng xà phòng và tráng lại bằng nước sạch trước lúc phơi khô.
4. Phương pháp soi tươi
Có thao tác đơn thuần và giản dị, tiến hành nhanh, thường được sử dụng để quan sát trạng thái sống của tế bào vi trùng.
4.1. Phương pháp thực thi
4.1.1. Dụng cụ
-Lam kính: dùng làm tiêu bản.
-Lam phủ (lamel, kính phủ vật): dùng để đậy lên những tiêu bản.
-Lam kính lõm: dùng để quan sát kĩ năng di động của vi trùng.
4.1.2. Chuẩn bị giọt canh khuẩn từ môi trường tự nhiên vạn vật thiên nhiên nuôi cấy
-Đặt ống chứa vi trùng vào giữa ngón cái và ngón trỏ của bàn tay trái, lòng bàn tay ngửa ra, ống nghiệm để hơi nghiêng nhưng không được khiến cho canh khuẩn chạm vào nút bông của ống nghiệm nuôi cấy vi trùng.
-Khử trùng que cấy trên ngọn đèn cồn. Để que cấy thẳng đứng trên ngọn lửa cho tới lúc đầu que cấy nóng đỏ rồi từ từ đặt và di tán que cấy theo chiều nằm ngang trên ngọn lửa.
-Kẹp nút bông vào giữa ngón út và lòng bàn tay phải, xoay nhẹ nút một vòng và kéo nút ra. Giữ nút như vậy cho tới lúc đậy nút vào.
-Đốt miệng ống nghiệm trên ngọn lửa đèn cồn.
-Đưa que cấy đã nguội vào ống nghiệm để lấy mẫu. Nếu ống giống là môi trường tự nhiên vạn vật thiên nhiên lỏng thì chỉ việc nhúng đầu que cấy vào canh trường rồi rút ra. Nếu giống mọc trên môi trường tự nhiên vạn vật thiên nhiên đặc thì dùng que cấy lấy một ít sinh khối vi sinh vật trên mặt thạch và hòa đều vào giọt nước cất vô trùng trên lam kính. Chú ý thao tác rất là nhẹ nhàng để khi lấy mẫu vi trùng không làm rách nát mặt thạch.
-Rút que cấy ra, đốt miệng ống nghiệm, đậy ống nghiệm lại và đặt ống
vào giá.
-Đặt giọt canh khuẩn (hoặc sinh khối vi sinh vật) ở đầu que cấy vào giữa phiến kính để làm tiêu bản.
-Khử trùng lại que cấy trên ngọn đèn rồi cất vào giá.
4.1.3. Tiêu bản giọt ép
-Dùng que cấy hoặc ống hút káy giống vi sinh vật để làm vết bôi.
-Đặt một mép kính phủ vật tiếp xúc với lam kính một góc 450rồi từ từ hạ xuống phủ giọt canh khuẩn thật nhẹ nhàng, tránh không tạo thành bọt khí.
4.1.4. Tiêu bản giọt treo
Dùng phiến kính đặc biệt quan trọng có phần lõm hình tròn trụ ở giữa.
-Cho một giọt canh khuẩn lên giữa kính phủ vật. Thận trọng xoay ngược lá kính cho giọt canh khuẩn quay xuống phía dưới rồi đặt lên phần lõm của phiến kính.
-Chú ý không giọt canh khuẩn phủ rộng rộng tự do ra hay chạm vào đáy của phần lõm.
-Đặt tiêu bản lên kính hiển vi và quan sát ở vật kính 10x hoặc 40x.
Trên thị trường nay đã xuất hiện một dụng cụ mang tên thường gọi là vòng O (O-ring) dùngđể thực thi giọt treo mà khôngcầnlam kính lõm.Đây là một miếng đệm hình tròn trụ, có kích thước vòng trong 12 mm, cao 3 mm hoàn toàn có thể sử dụng nhiều lần.Khi thực thi, người ta đặt vòng Olên giữa lam kính thường, đưa giọt canh khuẩn vào một trong những mặt của kính phủ vật, xoay ngược kính phủ vật và úp lên vòng O.Đây là tăng cấp cải tiến của nhà sản xuất Science Kit, một bộ O- ring 25 chiếc có mức giá khoảng chừng 20 USD.
5. Phương pháp nhuộm gram
Năm 1884, Hans Christian Joachim Gram, một nhà khoa học người Đan Mạch đã sáng tạo ra phương pháp nhuộm vi trùng mới mà ngày này tên thường gọi đã trở lên rất quen thuộc với mọi phòng thí nghiệm vi trùng toàn thế giới:
Phương pháp nhuộm gram là một trong những kỹ thuật cơ bản và quan trọng nhất trong phân tích vi trùng ở quy trình đầu nhằm mục đích xác lập sơ bộ đặc tính của những dòng vi trùng muốn nghiên cứu và phân tích theo tính chất bắt mầu gram của chúng.Vi khuẩn bắt mầu hỗn hợp crystal violet – iodin sẽ có được màu tím nâu khi quan sát dưới kính hiển vi quang học và được xếp vào nhóm vi trùng gram dương.Những dòng vi trùng khác không giữ được mầu crystal violet và bắt mầu fuchsin (đỏ) được xếp vào nhóm vi trùng gram âm.
Phương pháp nhuộm gram nhờ vào kĩ năng lưu giữ crystal violet của thành tế bào những dòng vi trùng sau khi bị tẩy bằng cồn. Việc xác lập thời hạn tẩy mầu là yếu tố quan trọng trong việc phân biệt vi trùng gram dương và vi trùng gram âm. Nếu kéo dãn thời hạn tẩy mầu, trong cả vi trùng gram dương cũng không giữ được mầu nhuộm ban đầu. Ngoài ra, một số trong những loài vi trùng gram dương cũng hoàn toàn có thể bị tẩy mầu thuận tiện và đơn thuần và giản dị và vì thế chúng sẽ là những dòng vi trùng có tính chất bắt mầu gram thay đổi (hoàn toàn có thể âm lẫn dương). Chất nhuộm fuchsin (hoặc hoàn toàn có thể thay bằng safranin) tạo cho vi trùng gram âm có mầu hồng đỏ. Fuchsin nhuộm mầu mạnh hơn và có mầu dễ nhìn hơn safranin. (Haemophilus spp., và một vài dòng vi trùng kỵ khí không ăn màu safranin)
5.1. Kỹ thuật nhuộm gram
5.1.1. Pha dung dịch thuốc nhuộm
a) Dung dịch Cristal violet:
* Dung dịch A:
– Crystal violet2 g
– Ethanol 95%20 ml
* Dung dịch B:
– Ammonium oxalat 0,8
– Nước cất..80 ml
Trộn đều 2 dung dich A và B, lọc qua giấy lọc thô, giữ ở nhiệt độ phòng trong chai mầu nâu.
b) Dung dịch Lugol:
– Indin tinh thể.1 g
– Potasium iodid…2 g
– Nước cất……………………………………….300 ml
Nghiền Iodin vào Potassium iodid trong 50 ml nước cất cho hòa tan hoàn toàn. Thêm phần nước cất còn sót lại, giữ ở nhiệt độ phòng trong chai nâu. Khi dung dịch mất mầu phải pha lại.
c) Dung dịch Carbon fuchsin:
* Dung dich A:
– Fuchsin0,3 g
– Ethanol 95%………………………………….10 ml
* Dung dịch B
– Phenol nóng chảy.5 ml
– Nước cất95 ml
Trộn đều dung dịch A và dung dich B, lọc qua giấy lọc thô.
d) Dung dịch Acid Alcohol:
– HCL..3 ml
– Ethanol cho đủ..100 ml
5.1.2. Cố định phiến phết
a) Từ môi trường tự nhiên vạn vật thiên nhiên lỏng
-Dùng bút sáp để ghi tên mẫu hoặc số nhận diện, ngày thử nghiệm. Vẽ vòng tròn để số lượng giới hạn vùng phiến phết vi trùng.
-Dùng khuyên cấy lấy một khuyên dịch khuẩn, dàn đều thành lớp mỏng dính số lượng giới hạn trong vòng tròn đã vẽ trên lam kính. Để dịch khuẩn tự khô hoàn toàn.
-Hơ mặt dưới của lam kínhqua lai trên ngọn lửa 2- 3 lần, tránh không để tiêu bản quá nóng.
b) Từ môi trường tự nhiên vạn vật thiên nhiên rắn
-Dùng bút sáp để ghi tên mẫu hoặc số nhân diện, ngày thử nghiệm. Vẽ vòng tròn để số lượng giới hạn vùng phiến phết vi trùng.
-Dùng khuyên cấy lấy một khuyên cấy nước cất vô trùng đặt vào giữa vòng tròn đã vẽ, lấy một lượng nhỏ vi trùng từ khuẩn lạc và dàn mỏng dính với nước cất trong vòng tròn. Để dịch khuẩn tự khô hoàn toàn.
-Hơ mặt dưới của lam kinh qua lại trên ngọn lửa 2 đến 3 lần, tránh không để tiêu bản quá nóng.
5.1.3. Tiến hành nhuộm
-Phủ dung dịch lên lam kính đã được cố định và thắt chặt trong một phút.
-Đổ bỏ dung dịch Crustal violet và rửa với nước cất.
-Phủ dung dịch làm cắn màu lugol trong một phút, tiếp theo đó đổ bỏ dung dịch lugol và rửa nhẹ với nước.
-Cầm một đầu lam kính, nhỏ từ từ cồn 950cho đến khi vùng phiến kính bạc màu di ( thời hạn tẩy cồn thông thường từ 10-15 giây). Rửa ngay với nước để chấm hết quy trình tẩy màu.
-Phủ dung dịch fuchsin lên lam kính 30 giây, đổ bỏ dung dịch và rửa qua nước.
-Dùng giấy thấm để thấm khô hoặc để khô tự nhiên. Khảo sát hình thể và tính chất bắt mầu của vi trùng dưới kính hiển vi với vật kính dầu.
5.2. Nguyên nhân một số trong những sai lệch trong phương pháp nhuộm gram
5.2.1. Gram dương trở thành gram âm
-Lứa cấy quá già: vi trùng trong quy trình biến dưỡng sinh ramột số chất hoàn toàn có thể làm tăng tính acid của môitrường nuôi cấy gây sai lệchkết quả.Tốt nhất lên nhuộm gram với lứa cấy từ 18-24 giờ.
-Dung dịch Lugol bị hỏng:phải dữ gìn và bảo vệ dung dịch lugol trong chai nâu, tránh ánh sáng và cần vô hiệu ngay lúc thấy dung dịch chuyển màu từ nâu sang vàng.
-Tẩy màu quá mức cần thiết:nhỏ quá nhiều cồn hoặc không rửa nước ngay.
5.2.2. Gram âm trở thành gram dương
-Cố định tiêu bản lúc còn ướt, những hợp chất protein có trong môi trường tự nhiên vạn vật thiên nhiên họăc trong mẫu thử làm tiêu bản khó tẩy màu.
-Tẩy màu chưa đạt.
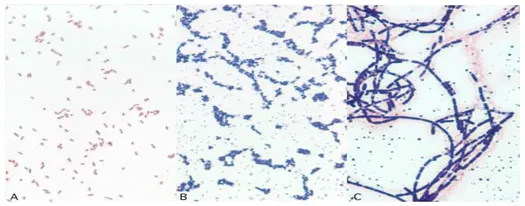
Phản ứng với thuốc nhuộm của những chủng vi trùng
A:E. coli, gram (-)
B:Staphylococcus epidermidis, Gram (+)
C: Bacillus cereus, Gram (+).
6. Các thử nghiệm sinh vật hoá học
6.1. Lên men đường
Thử nghiệm lên men trong môi trường tự nhiên vạn vật thiên nhiên canh thang có chứa đường, pepton và cao thịt (để phục vụ những dinh dưỡng phụ cho những vi sinh vật khó lên men), và chất thông tư mầu tía cresol brom (chất thông tư pH). Nếu có sự lên men đường, thường sinh ra acid. Trường hợp này pH môi trường tự nhiên vạn vật thiên nhiên hạ xuống đã làm cho màu tía cresol brom chuyển từ xanh sang vàng. Cũng như vậy, nếu thêm ống Durham, sẽ tiến hành cho phép xác lập sự sinh hơi (H2) từ quy trình lên men. Kết quả vấn đáp ở đầu cuối là sinh acid (+/-) và gas (+/-).
Phản ứng lên men trong MT canh thang:
Nếu vi trùng không lên men với test đường thì thuốc nhuộm màu tía vẫn còn đấy sót lại và không sinh gas (trái). Nếu quả trình lên men xẩy ra, hầu hết là sinh ra acid, khi đó pH giảm và làm đổi màu của canh thang sang màu vàng (giữa). Nếu sinh gas, ống Durham ở trong hòn đảo ngược lên và nhìn như có khủng hoảng rủi ro không mong muốn cục bộ bong bóng (phải).
6.2. Thủy phân tinh bột
Đĩa thạch tinh bột được sử dụng để thử tính chất thủy phân tinh bột ngoại bào. Tinh bột là một trong phân tử polysacchrid có trọng lượng quá rộng để hoàn toàn có thể dịch chuyển vào trong tế bào mà bước đầu không cần bẻ gãy thành những cty nhỏ hơn. Khả năng thủy phân tinh bột tùy từng sự sản xuất và bài tiết một số trong những men để giáng phân polymer. Sự phá vỡ tinh bột được trao thấy sau khi ủ ngập đĩa với iod. Phức hợp iod với tinh bột nguyên chất có màu xanh. Nếu vi trùng hoàn toàn có thể phá hủy tinh bột, không còn phản ứng xẩy ra và ta thấy xuất hiện một vùng trống (không màu) quanh khuẩn lạc.
Thủy phân tinh bột:
Các vi trùng hoàn toàn có thể sử dụng tinh bột để tiết ra men amylase, men này được sử dụng để thủy phân tinh bột. Quá trình tinh bột bị phá vỡ được quan sát thấy khi ta ngâm đĩa tinh bột với iod, quy trình này đã tạo ra phức tạp màu tía.
Các vi trùng thử nghiệm không hoàn toàn có thể phá vỡ tinh bột sẽ tạo ra đường viền khá đầy đủ do một vùng màu tía (trái). Khi tinh bột bị phá vỡ sẽ tạo ra một vùng sáng xung quanh đường cấy, trong lúc nền của đĩa là màu tía (phải).
6.3. Thử nghiệm Catalase
Môi trường thạch tim (HIA) được sử dụng như một môi trường tự nhiên vạn vật thiên nhiên cho nhiều mục tiêu, như để xác nhận hình thái khuẩn lạc và phản ứng catalase. Trong suốt quy trình chuyển hoá oxy được tạo ra đã làm nhiễm độc những tế bào, khi đó những enzym đặc biệt quan trọng của vi trùng được tạo ra để giải độc những hợp chất đó. Một trong những enzym đó là catalase có tác dụng phân giải H2O2tạo thành oxy và nước. Đây là một thử nghiệm thuận tiện và đơn thuần và giản dị để phát hiện enzym này trong vi trùng khi sử dụngH2O2 3%.
Phản ứng catalase với những chủng thử nghiệm
6.4. Giáng hoá tryptophan thành Indole
Canh thang Tryptone chứa nồng độ cao amino acid tryptophan. Một số vi sinh vật hoàn toàn có thể phân hủy tryptophan thành indole và kĩ năng này được sử dụng để phân biệt những vi trùng. Thử nghiệm được thực thi bằng phương pháp thêm chất thử Kovac vào canh cấy, kết quả là nếu xuất hiện indole thì sẽ có được vòng red color ở phía trên của canh cấy. Ví dụ, phản ứng dương tính và âm tính của thử nghiệm indole trong hình 7.
Quá trình giáng hoá indole
Dương tính cho một vòng tròn máu đỏ phía trên môi trường tự nhiên vạn vật thiên nhiên (trái), âm tính là một trong vòng tròn mầu nâu hoặc trong mờ đục (phải).
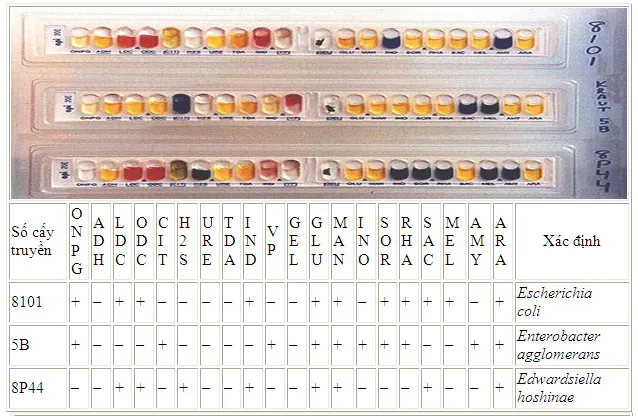
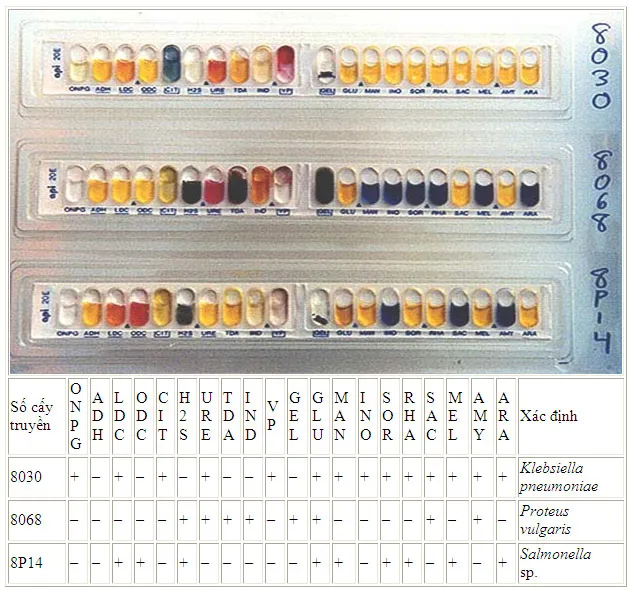
Việc xác lập những vi sinh vật bằng những thử nghiệm hoá sinh trên đã được thực thi qua nhiều thế kỷ và được tiêu chuẩn hoá. Để những thử nghiệm này được tiến hành thuận tiện hơn, những nhà sản xuất đã sản xuất ra những bộ kit chẩn đoán nhanh để định danh vi trùng, ví như strip Api 20.
Các phản ứng sinh hoá trên bộ Api-20
Các thử nghiệm hoá sinh ở đây đã được nghiên cứu và phân tích và thu nhỏ. Strip Api-20 là một ví dụ về những thử nghiệm loại này, mỗi Strip có 20 test được thực thi bằng phương thức đơn thuần và giản dị giúp tiết kiệm chi phí thời hạn và kinh phí góp vốn đầu tư. Thử nghiệm thứ nhất giúp nhận ra sự xuất hiện của enzyme õ-galatosidase, đấy là enzym có liên quan tới quy trình dị hoá lactose. Ba phản ứng tiếp theo (theo thứ tự là arginin, lysin and ornithin) là thử nghiệm tách carboxyl của amino acid. Phản ứng decarboxyl được đã cho toàn bộ chúng ta biết bằng 1 phản ứng kiềm (red color của chất thông tư đặc hiệu được sử dụng). Chín thử nghiệm tiếp theo là xác lập sự lên men carbohydrat (glucose, mannitol, inositol, sorbitol, rhamnose, sucrose, melibiose, amygdalin và arabinose). Sự lên men được thể hiện bằng 1 phản ứng acid (màu vàng của chất thông tư). Sự xuất hiện của thành phầm H2S và gelatin hydrolysis (GEL) được thể hiện bằng mầu đen bao trùm khắp ống. Phản ứng dương tính của tryptophan deaminase (TDA) thể hiện bằng màu nâu sẫm khi thêm thuốc thử là FeCl3. Kết quả dương tính của test này giống với phản ứng dương tính của phenylalanin và lysie deaminase, là những phản ứng đặc trưng củaProteus,MorganellaandProvidencia.
7. Các kỹ thuật phát hiện kháng thể, kháng nguyên và AND của vi trùng
Một trong những hạn chế của những thử nghiệm sinh hoá là vi sinh vật phải tăng trưởng trên một vài môi trường tự nhiên vạn vật thiên nhiên nào đó và thời hạn cần tối thiểu là 12 – 24 giờ để đọc kết quả. Trên thực tiễn, những chủng thử nghiệm hoàn toàn có thể bị đột biến cho nên vì thế không thực thi được chuyển hoá thông thường như chủng chuẩn khác, ví dụ hầu hết những loài E.coli hoàn toàn có thể sử dụng lactose như một nguồn carbon, tuy nhiên những E.coli phân lập được lại không hoàn toàn có thể sử dụng lactose. Mặt khác, trong một số trong những trường hợp nuôi cấy phân lập vi trùng hoàn toàn có thể bị thất bại do việc sử dụng kháng sinh để điều trị. Để khắc phục những nhược điểm này, những kỹ thuật phát hiện kháng nguyên, kháng thể và vật tư di truyền của vi trùng là những công cụ hữư hiệu nhất ngày càng được sử dụng rộng tự do.
7.1. Các kỹ thuật phát hiện kháng nguyên
-Kỹ thuật ngưng kết hạt (Partical Agglutination).
-Thử nghiệm kết tủa (Precipilin Tests).
-Kỹ thuật nhuộm với kháng thể gắn huỳnh quang.
-Thử nghiệm miễn dịch pha rắn với kháng thể gắn enzym.
7.2. Các kỹ thuật phát hiện kháng thể
-Kỹ thuật ngưng kết hạt (Partical Agglutination).
-Kỹ thuật tủa (Precipitation Assay).
-Kỹ thuật phối hợp bổ thể (Complêmnt Fixation test).
-Kỹ thuật miễn dịch gắn enzym.
-Kỹ thuật Western Blotting.
TÀI LIỆU THAM KHẢO
1.Lê Huy Chính.Vi sinh Y học. Nhà xuất bản Y học.2001. 12 – 37, 100-119.
2. Diagnostic Microbiology.Connie R., Mahon M.S., Giorge Manuselis J.R., W.B Saunder Company.1995.
3. Diagnostic Procudures for Bacterial, Mycotic, and parasitic infections,5th. Bodily.Howard L., Ypdyke, Elaine L, Jame O. American Public Health Association, Inc, Tp New York, 1970.
Reply
1
0
Chia sẻ
Share Link Cập nhật Plaque assay là gì miễn phí
Bạn vừa đọc nội dung bài viết Với Một số hướng dẫn một cách rõ ràng hơn về Video Plaque assay là gì tiên tiến và phát triển nhất và Chia Sẻ Link Cập nhật Plaque assay là gì Free.

Giải đáp vướng mắc về Plaque assay là gì
Nếu sau khi đọc nội dung bài viết Plaque assay là gì vẫn chưa hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Ad lý giải và hướng dẫn lại nha
#Plaque #assay #là #gì