Thủ Thuật Hướng dẫn Bài Thu hoạch Tính chất hóa học của nhôm và sắt 2022
Bạn đang tìm kiếm từ khóa Bài Thu hoạch Tính chất hóa học của nhôm và sắt được Cập Nhật vào lúc : 2022-03-02 12:30:10 . Với phương châm chia sẻ Mẹo về trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi tìm hiểu thêm nội dung bài viết vẫn ko hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Ad lý giải và hướng dẫn lại nha.
Các em sẽ thực thi một số trong những phản ứng hóa học của nhôm và sắt với những chất rất khác nhau. Từ đó khắc sâu thêm kiến thức và kỹ năng về tính chất chất hóa học của nhôm và sắt.
Nội dung chính
- I. Tiến Hành Thí Nghiệm
- II. Viết Bảng Tường Trình
Khắc sâu kiến thức và kỹ năng hoá học của nhôm và sắt
Rèn kĩ năng thực hành thực tiễn hoá học, kĩ năng làm bài tập thực hành thực tiễn hoá học.
Rèn tính thận trọng, kiên trì trong học tập và thực hành thực tiễn hoá học.
Có những hạt loé sáng do bột nhôm tác dụng với oxi, phản ứng toả nhiều nhiệt.
Bột nhôm cháy sáng, tạo ra chất rắn white color Al2O3
Khi đun hỗn hợp trên ngọn lửa đèn cồn, sắt tác dụng mạnh với lưu huỳnh hỗn hợp cháy nóng đỏ, phản ứng toả nhiều nhiệt.
Chất tạo thành có màu đen (không biến thành nam châm hút hút)
Mục tiêu:
I. Tiến Hành Thí Nghiệm
1. Thí nghiệm 1: Tác dụng của nhôm với oxi
Yêu cầu: Nêu hiện tượng kỳ lạ thí nghiệm, cho biết thêm thêm trạng thái, sắc tố của chất tạo thành, lý giải và viết phương trình phản ứng. Cho biết vai trò của nhôm trong phản ứng?
Dụng cụ: Đèn cồn, muỗng lấy hóa chất, bìa cứng (hoặc công tơ hút).
Hóa chất: Bột nhôm.
Cách tiến hành:
+ Lấy một ít bột nhôm vào tấm bìa cứng (hoặc công tơ hút).
+ Rắc nhẹ bột nhôm trên ngọn lửa đèn cồn.
+ Quan sát hiện tượng kỳ lạ, cho biết thêm thêm trạng thái, sắc tố chất tạo thành.
Hiện tượng:
Giải thích: Vì xẩy ra phản ứng nhôm tác dụng với oxi trong không khí
PTHH: 4Al + 3O2 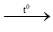 2Al2O3
2Al2O3
Trong phản ứng hóa học: nhôm đóng vai trò là chất khử.
2. Thí nghiệm 2: Tác dụng của sắt với lưu huỳnh
Yêu cầu: Cho biết sắc tố của hỗn hợp sắt và lưu huỳnh trước phản ứng. Nêu hiện tượng kỳ lạ thí nghiệm, sắc tố của chất tạo thành sau phản ứng, lý giải và viết phương trình phản ứng?
Dụng cụ: Kẹp gỗ (hoặc giá thí nghiệm), đèn cồn, muỗng lấy hóa chất, bát sứ.
Hóa chất: Bột sắt, bột lưu huỳnh.
Cách tiến hành
+ Lấy 2 thìa nhỏ hỗn hợp bột Fe, S theo tỉ lệ: mFe : mS = 7:4 (hoặc 1:3 về thể tích)
+ Đun nóng ống nghiệm chứa hỗn hợp trên ngọn lửa đèn cồn đến khi có đốm sáng đỏ xuất hiện thì bỏ đèn cồn ra.
Hiện tượng:
Giải thích:
– Vì xẩy ra phản ứng sắt tác dụng với lưu huỳnh
– Hỗn hợp cháy nóng đỏ tạo ra chất rắn màu đen.
PTHH: Fe + S 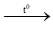 FeS
FeS
3. Thí nghiệm 3: Nhận biết sắt kẽm kim loại Al, Fe
Có bột hai sắt kẽm kim loại: Nhôm, Sắt đựng trong hai lọ rất khác nhau (không còn nhãn). Hãy nhận ra mỗi sắt kẽm kim loại bằng phương pháp hóa học.
Yêu cầu: Quan sát hiện tượng kỳ lạ xẩy ra ở hai ống nghiệm 1 và 2. Cho biết mỗi lọ đựng sắt kẽm kim loại nào? Giải thích và viết phương trình phản ứng?
Cách tiến hành:
+ Lấy một ít bột sắt kẽm kim loại Al, Fe vào 2 ống nghiệm (1) và (2).
+ Nhỏ 1 – 2 ml dung dịch NaOH vào từng ống nghiệm (1) và (2).
+ Quan sát hiện tượng kỳ lạ xẩy ra trong từng ống nghiệm.
+ Cho biết hoá chất đựng trong từng ống nghiệm. Giải thích, kết luận hoá chất trong mọi lọ, viết phương trình phản ứng.
Hiện tượng:
– Ống nghiệm 1: Có khí không màu thoát ra làm sắt kẽm kim loại Al
– Ống nghiệm 2: Không có hiện tượng kỳ lạ đó là sắt kẽm kim loại Fe.
Kết luận: ống nghiệm có khí thoát ra là ống nghiệm trước đó chứa bột Al. ống nghiệm không còn hiện tượng kỳ lạ gì là ống nghiệm trước đó chứa bột Fe ⇒ ta nhận ra được lọ đựng sắt kẽm kim loại Al và lọ đựng sắt kẽm kim loại Fe
Giải thích: Vì Nhôm có phản ứng với kiềm, còn sắt thì không phản ứng với kiềm.
Thông qua nội dung thực hành thực tiễn toàn bộ chúng ta chứng tỏ được những tính chất hoá học nào của Al và Fe?
+ Al và Fe tác dụng được với phi kim → oxit hoặc muối.
+ Al tác dụng được với dung dịch kiềm → muối và khí H2
II. Viết Bảng Tường Trình
STT
Hiện tượng quan sát được
Giải thích hiện tượng kỳ lạ
Phương trình hóa học
Kết luận
Thí nghiệm 1
Nhôm cháy sáng tạo thành chất rắn white color.
Do nhôm tác dụng với oxi không khí, phản ứng tỏa nhiều nhiệt
4Al + 3O2 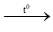 2Al2O3
2Al2O3
Nhôm phản ứng với oxi.
Thí nghiệm 2
Sắt tác dụng mạnh với lưu huỳnh, hỗn hợp cháy nóng đỏ, phản ứng tỏa nhiều nhiệt.
Do sắt tác dụng với lưu huỳnh, phản ứng tỏa nhiều nhiệt.
Fe + S 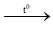 FeS
FeS
Sắt phản ứng với lưu huỳnh.
Thí nghiệm 3
Ống nghiệm 1: không còn hiện tượng kỳ lạ gì.
Ống nghiệm 2: có bọt khí không màu thoát ra, sắt kẽm kim loại tan dần.
Do sắt không phản ứng với dung dịch kiềm.
Do nhôm tác dụng với dung dịch kiềm.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Ống nghiệm 1: là sắt kẽm kim loại sắt
Ống nghiệm 2: là sắt kẽm kim loại nhôm
Trên là mẫu báo cáo và bản tường trình bài 23 thực hành thực tiễn Tính chất hóa học của nhôm và sắt chương 2 hóa học lớp 9. Bài học giúp những bạn thực thi một số trong những thí nghiệm phản ứng nhôm và sắt với những chất rất khác nhau. Hi vọng qua nội dung bài thực hành thực tiễn những bạn nắm kiến thức và kỹ năng một cách tốt nhất.
Hoá học 9 Bài 23: Thực hành Tính chất hóa học của nhôm và sắt giúp những em học viên lớp 9 biết phương pháp thực thi một số trong những phản ứng hóa học của nhôm và sắt với một số trong những chất khác.
Từ đó ghi nhớ hơn kiến thức và kỹ năng về nhôm và sắt để học tốt Hóa 9. Vậy sau này là nội dung rõ ràng tài liệu, mời những bạn cùng theo dõi tại đây. Hãy tìm hiểu thêm với Mobitool nhé.
Yêu cầu: Nêu hiện tượng kỳ lạ thí nghiệm, cho biết thêm thêm trạng thái, sắc tố của chất tạo thành, lý giải và viết PTPƯ. Cho biết vai trò của nhôm trong phản ứng?
Hiện tượng: Có những hạt loé sáng do bột nhôm tác dụng với oxi, phản ứng toả nhiều nhiệt.
Chất tạo thành white color sáng là nhôm oxit Al2O3.
Giải thích: Vì xẩy ra phản ứng nhôm tác dụng với oxi trong không khí.
Trong PƯHH nhôm đóng vai trò là chất khử.
Phương trình hóa học:
4Al + 2O2 2Al2O3
Yêu cầu: Cho biết sắc tố của hỗn hợp sắt và lưu huỳnh trước phản ứng. Nêu hiện tượng kỳ lạ thí nghiệm, sắc tố của chất tạo thành sau phản ứng, lý giải và viết PTPƯ? và viết bản tường trình hóa học 9 bài 23.
Hiện tượng: Khi đun hỗn hợp trên ngọn lửa đèn cồn, sắt tác dụng mạnh với lưu huỳnh hỗn hợp cháy nóng đỏ, phản ứng toả nhiều nhiệt.
Chất tạo thành có màu đen (không biến thành nam châm hút hút).
Giải thích: Vì xẩy ra phản ứng sắt tác dụng với lưu huỳnh.
Fe + S FeS
Hỗn hợp sắt và lưu huỳnh trước phản ứng có màu xám.
Yêu cầu: Quan sát hiện tượng kỳ lạ xẩy ra ở hai ống nghiệm 1 và 2. Cho biết mỗi lọ đựng sắt kẽm kim loại nào? Giải thích và viết PTPƯ?
Hiện tượng: Khi cho dung dịch NaOH vào hai ống nghiệm. Một ống nghiệm có khí thoát ra và chất rắn tan ra. Một ống nghiệm không còn hiện tượng kỳ lạ gì.
Kết luận: Ống nghiệm có khí thoát ra là ống nghiệm trước đó chứa bột Al. Ống nghiệm không còn hiện tượng kỳ lạ gì là ống nghiệm trước đó chứa bột Fe => ta nhận ra được lọ đựng sắt kẽm kim loại Al và lọ đựng sắt kẽm kim loại Fe.
Giải thích: Vì nhôm có phản ứng với kiềm, còn sắt thì không phản ứng với kiềm.
Phương trình hóa học:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Họ và tên: ………………………………………………….
Lớp: …………………………………………………………..
I. Dụng cụ hóa chất
1. Dụng cụ
Đèn cồn, muỗng lấy hóa chất, bìa cứng (hoặc công tư hút), kẹp gỗ (hoặc giá thí nghiệm), muỗng lấy hóa chất, bát sứ
2. Hóa chất.
Bột nhôm, bột sắt, bột lưu huỳnh, sắt kẽm kim loại nhôm, sắt kẽm kim loại sắt, dung dịch NaOH,…
II. Bản tường trình bài thực hành thực tiễn hóa 9 bài 23
Các tiến hành Hiện tượng Giải thích, PTHH Thí nghiệm 1: Tác dụng của nhôm với oxi Lấy một ít bột nhôm vào tấm bìa cứng (hoặc công tơ hút). Rắc nhẹ bột nhôm trên ngọn lửa đèn cồn.
Quan sát hiện tượng kỳ lạ, cho biết thêm thêm trang thái, sắc tố chất tạo thành.
Có những hạt loé sáng do bột nhôm tác dụng với oxi, phản ứng toả nhiều nhiệt.
Chất tạo thành white color sáng là nhôm oxit Al2O3.
Vì xẩy ra phản ứng nhôm tác dụng với oxi trong không khí.
Trong PƯHH nhôm đóng vai trò là chất khử.
Phương trình hóa học:
4Al + 2O2 2Al2O3
Thí nghiệm 2: Tác dụng của sắt với lưu huỳnh. Lấy 2 thài nhỏ hỗn hợp bột sắt, lưu huỳnh theo tỉ lệ mFe : mS = 7:4 (hoặc 1:3 về thể tích)
Đun nóng ống nghiệm chứa hốn hợp trên ngọn lửa đèn cồn đến khi có đốm sáng đỏ xuất hiện thì bỏ đèn cồn ra
Khi đun hỗn hợp trên ngọn lửa đèn cồn, sắt tác dụng mạnh với lưu huỳnh hỗn hợp cháy nóng đỏ, phản ứng toả nhiều nhiệt.
Chất tạo thành có màu đen (không biến thành nam châm hút hút).
Vì xẩy ra phản ứng sắt tác dụng với lưu huỳnh.
Fe + S FeS
Hỗn hợp sắt và lưu huỳnh trước phản ứng có màu xám.
Thí nghiệm 3: Nhận biết mỗi sắt kẽm kim loại Al, Fe được đựng trong hai lọ không dán nhãn. Lấy một ít bột sắt kẽm kim loại Al, Fe vào 2 ống nghiệm (1) và (2)
Nhỏ 1-2 ml dung dịch NaOH vào từng ống nghiệm (1) và (2)
Quan sát hiện tượng kỳ lạ xẩy ra trong từng ống nghiệm
Khi cho dung dịch NaOH vào hai ống nghiệm. Một ống nghiệm có khí thoát ra và chất rắn tan ra. Một ống nghiệm không còn hiện tượng kỳ lạ gì. Vì nhôm có phản ứng với kiềm, còn sắt thì không phản ứng với kiềm.
Phương trình hóa học:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Hoá học 9 Bài 23: Thực hành Tính chất hóa học của nhôm và sắt giúp những em học viên lớp 9 biết phương pháp thực thi một số trong những phản ứng hóa học của nhôm và sắt với một số trong những chất khác.
Từ đó ghi nhớ hơn kiến thức và kỹ năng về nhôm và sắt để học tốt Hóa 9. Vậy sau này là nội dung rõ ràng tài liệu, mời những bạn cùng theo dõi tại đây.
Yêu cầu: Nêu hiện tượng kỳ lạ thí nghiệm, cho biết thêm thêm trạng thái, sắc tố của chất tạo thành, lý giải và viết PTPƯ. Cho biết vai trò của nhôm trong phản ứng?
Hiện tượng: Có những hạt loé sáng do bột nhôm tác dụng với oxi, phản ứng toả nhiều nhiệt.
Chất tạo thành white color sáng là nhôm oxit Al2O3.
Giải thích: Vì xẩy ra phản ứng nhôm tác dụng với oxi trong không khí.
Trong PƯHH nhôm đóng vai trò là chất khử.
Phương trình hóa học:
4Al + 2O2 2Al2O3
Yêu cầu: Cho biết sắc tố của hỗn hợp sắt và lưu huỳnh trước phản ứng. Nêu hiện tượng kỳ lạ thí nghiệm, sắc tố của chất tạo thành sau phản ứng, lý giải và viết PTPƯ?
Hiện tượng: Khi đun hỗn hợp trên ngọn lửa đèn cồn, sắt tác dụng mạnh với lưu huỳnh hỗn hợp cháy nóng đỏ, phản ứng toả nhiều nhiệt.
Chất tạo thành có màu đen (không biến thành nam châm hút hút).
Giải thích: Vì xẩy ra phản ứng sắt tác dụng với lưu huỳnh.
Fe + S FeS
Hỗn hợp sắt và lưu huỳnh trước phản ứng có màu xám.
Yêu cầu: Quan sát hiện tượng kỳ lạ xẩy ra ở hai ống nghiệm 1 và 2. Cho biết mỗi lọ đựng sắt kẽm kim loại nào? Giải thích và viết PTPƯ?
Hiện tượng: Khi cho dung dịch NaOH vào hai ống nghiệm. Một ống nghiệm có khí thoát ra và chất rắn tan ra. Một ống nghiệm không còn hiện tượng kỳ lạ gì.
Kết luận: Ống nghiệm có khí thoát ra là ống nghiệm trước đó chứa bột Al. Ống nghiệm không còn hiện tượng kỳ lạ gì là ống nghiệm trước đó chứa bột Fe => ta nhận ra được lọ đựng sắt kẽm kim loại Al và lọ đựng sắt kẽm kim loại Fe.
Giải thích: Vì nhôm có phản ứng với kiềm, còn sắt thì không phản ứng với kiềm.
Phương trình hóa học:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Họ và tên: ………………………………………………….
Lớp: …………………………………………………………..
I. Dụng cụ hóa chất
1. Dụng cụ
Đèn cồn, muỗng lấy hóa chất, bìa cứng (hoặc công tư hút), kẹp gỗ (hoặc giá thí nghiệm), muỗng lấy hóa chất, bát sứ
2. Hóa chất.
Bột nhôm, bột sắt, bột lưu huỳnh, sắt kẽm kim loại nhôm, sắt kẽm kim loại sắt, dung dịch NaOH,…
II. Bản tường trình bài thực hành thực tiễn hóa 9 bài 23
Các tiến hành Hiện tượng Giải thích, PTHH Thí nghiệm 1: Tác dụng của nhôm với oxi Lấy một ít bột nhôm vào tấm bìa cứng (hoặc công tơ hút). Rắc nhẹ bột nhôm trên ngọn lửa đèn cồn.
Quan sát hiện tượng kỳ lạ, cho biết thêm thêm trang thái, sắc tố chất tạo thành.
Có những hạt loé sáng do bột nhôm tác dụng với oxi, phản ứng toả nhiều nhiệt.
Chất tạo thành white color sáng là nhôm oxit Al2O3.
Vì xẩy ra phản ứng nhôm tác dụng với oxi trong không khí.
Trong PƯHH nhôm đóng vai trò là chất khử.
Phương trình hóa học:
4Al + 2O2 2Al2O3
Thí nghiệm 2: Tác dụng của sắt với lưu huỳnh. Lấy 2 thài nhỏ hỗn hợp bột sắt, lưu huỳnh theo tỉ lệ mFe : mS = 7:4 (hoặc 1:3 về thể tích)
Đun nóng ống nghiệm chứa hốn hợp trên ngọn lửa đèn cồn đến khi có đốm sáng đỏ xuất hiện thì bỏ đèn cồn ra
Khi đun hỗn hợp trên ngọn lửa đèn cồn, sắt tác dụng mạnh với lưu huỳnh hỗn hợp cháy nóng đỏ, phản ứng toả nhiều nhiệt.
Chất tạo thành có màu đen (không biến thành nam châm hút hút).
Vì xẩy ra phản ứng sắt tác dụng với lưu huỳnh.
Fe + S FeS
Hỗn hợp sắt và lưu huỳnh trước phản ứng có màu xám.
Thí nghiệm 3: Nhận biết mỗi sắt kẽm kim loại Al, Fe được đựng trong hai lọ không dán nhãn. Lấy một ít bột sắt kẽm kim loại Al, Fe vào 2 ống nghiệm (1) và (2)
Nhỏ 1-2 ml dung dịch NaOH vào từng ống nghiệm (1) và (2)
Quan sát hiện tượng kỳ lạ xẩy ra trong từng ống nghiệm
Khi cho dung dịch NaOH vào hai ống nghiệm. Một ống nghiệm có khí thoát ra và chất rắn tan ra. Một ống nghiệm không còn hiện tượng kỳ lạ gì. Vì nhôm có phản ứng với kiềm, còn sắt thì không phản ứng với kiềm.
Phương trình hóa học:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Chia Sẻ Link Cập nhật Bài Thu hoạch Tính chất hóa học của nhôm và sắt miễn phí
Bạn vừa đọc tài liệu Với Một số hướng dẫn một cách rõ ràng hơn về Clip Bài Thu hoạch Tính chất hóa học của nhôm và sắt tiên tiến và phát triển nhất và Chia SẻLink Tải Bài Thu hoạch Tính chất hóa học của nhôm và sắt miễn phí.

Thảo Luận vướng mắc về Bài Thu hoạch Tính chất hóa học của nhôm và sắt
Nếu sau khi đọc nội dung bài viết Bài Thu hoạch Tính chất hóa học của nhôm và sắt vẫn chưa hiểu thì hoàn toàn có thể lại phản hồi ở cuối bài để Admin lý giải và hướng dẫn lại nha
#Bài #Thu #hoạch #Tính #chất #hóa #học #của #nhôm #và #sắt
