Mẹo về Công thức tổng quát của amin bậc 2 Mới Nhất
You đang tìm kiếm từ khóa Công thức tổng quát của amin bậc 2 được Update vào lúc : 2022-05-29 19:00:07 . Với phương châm chia sẻ Mẹo về trong nội dung bài viết một cách Chi Tiết Mới Nhất. Nếu sau khi Read nội dung bài viết vẫn ko hiểu thì hoàn toàn có thể lại phản hồi ở cuối bài để Ad lý giải và hướng dẫn lại nha.
Tính Chất Hóa Học Của Amin Bậc 1 – Amin Thơm – Amin Béo
Amin là gì?
– Amin là hợp chất hữu cơ được tạo ra khi thế một hoặc nhiều nguyên tử hiđro trong phân tử amoniac bằng một hoặc nhiều gốc hiđrocacbon.
Ví dụ: NH2 (amoniac) ; CH3-NH2 (metylamin) ; C6H5-NH2 (phenylamin) ; CH3-NH-CH3 (đimetylamin)
2. Phân loại Amin
– Amin được phân loại theo 2 cách thông dụng:
a) Theo điểm lưu ý cấu trúc của gốc hiđrocacbon
– Amin mạch hở: CH3NH2 , C2H5NH2 , …
– Amin mạch vòng: C6H5NH2 , CH3C6H4NH2 , …
b) Theo bậc của amin
– Bậc amin: là số nguyên tử H trong phân tử NH3 bị thay thế bởi gốc hiđrocacbon. Theo đó, những amin được phân loại thành: amin bậc 1, bậc 2, bậc 3.
– Công thức cấu trúc (bậc) của amin:
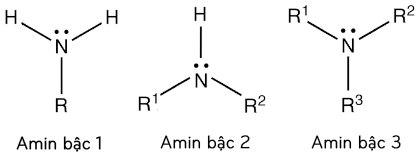
Ví dụ: CH3-CH2-CH2-NH2 (amin bậc 1) ; CH3-CH2-NH-CH3 (amin bậc 2) ; (CH3)3N (amin bậc 3).
– Công thức tổng quát của amin: CxHyNz (x, y, z ∈ N*; y ≤ 2x + 2 + z; y chẵn nếu z chẵn; y lẻ nếu z lẻ).
hoặc: CnH2n+2-2k+tNt (n ∈ N*; k ∈ N; t ∈ N*).
Tính chất hoá học của Amin
1. Tính bazơ của Amin
– Các phản ứng thể hiện tính bazơ
a) Amin tác dụng với dung dịch axit
CH3NH2 + H2SO4 → CH3NH3HSO4
2CH3NH2 + H2SO4 → (CH3NH3)2SO4
CH3NH2 + CH3COOH → CH3NH3OOCCH3
b) Amin tác dụng với dung dịch muối tạo bazơ không tan
2CH3NH2 + MgCl2 + 2H2O → Mg(OH)2 + 2CH3NH3Cl
3. Phản ứng nhận ra bậc của amin
– Nếu là amin bậc I khi phản ứng với HNO2 tạo khí thoát ra:
RNH2 + HNO2 → ROH + N2 + H2O
– Anilin phản ứng tạo muối điazoni ở 0 → 50C:
C6H5NH2 + HNO2 → C6H5N2+Cl– + 2H2O
– Nếu là amin bậc II thì tạo hợp chất nitrozo màu vàng nổi trên mặt nước:
RNHR’ + HNO2 → RN(NO)R’ + H2O
– Amin bậc III không còn phản ứng này.
4. Phản ứng nâng bậc amin
RNH2 + R’I → RNHR’ + HI
RNHR’ + R’’I → RNR’R’’ + HI
5. Phản ứng riêng của Anilin
– Anilin là amin thơm nên không làm đổi màu quỳ tím thành xanh.
– Anilin tạo kết tủa trắng với dung dịch nước Brom:
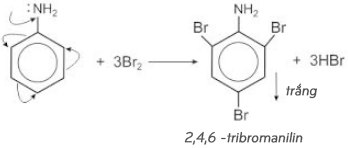 ⇒ Phản ứng này được sử dụng để nhận ra anilin.
⇒ Phản ứng này được sử dụng để nhận ra anilin.
TAGs : amino metylamin trình diễn bản
Các kiến thức và kỹ năng liên quan trong chương Amin, Amino Axit Và Protein bạn hoàn toàn có thể quan tâm:
Các dạng bài tập Amin trọng điểm hay có trong kì thi
Lý thuyết về Peptit và Protein hay gặp trong đề thi THPT
Lý thuyết Anilin C6H7N: tính chất hóa học, tính chất vật lí, điều chế, ứng dụng
Lý thuyết amino axit: cách gọi tên, tính chất hóa học, tính chất vật lí, điều chế, ứng dụng
Lý thuyết Amin
Khi ta thay thế nguyên tử H trong phân tử NH3 bằng gốc hidrocacbon ta thu được Amin.
Bậc của Amin đó đó là số nguyên tử H được thay thế
Công thức tổng quát của Amin
Amoniac
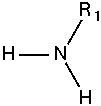
Amin bậc 1
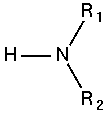
Amin bậc 2
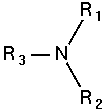
Amin bậc 3
Còn nếu nhóm amin link với vòng benzen, toàn bộ chúng ta có hợp chất amin thơm. Hợp chất đơn thuần và giản dị nhất của dãy amin thơm là anilin.
- Các amin thấp như những metylamin, đimetylamin, trimetylamin và etylamin là những chất khí, có mùi gần tương tự amoniac, tan nhiều trong nước.
- Các amin bậc cao hơn là những chất lỏng, có một số trong những là chất rắn. Nhiệt độ sôi tăng dần và độ tan trong nước giảm dần theo chiều tăng của phân tử khối
- Các amin thơm là chất lỏng hoặc rắn, dễ bị oxy hóa. Từ không màu chuyển thành màu đen khi để trong không khí do bị oxy hóa
- Các amin đều độc
- Nhúng quỳ tím vào dung dịch metylamin hoặc propylamin, quỳ tím=> chuyển xanh. Do khi tan trong nước sinh ra ion OH–. Ví dụ:
CH3NH2 + H2O → ⌈CH3NH3⌉+ +OH–
- Nhờ có tính bazơ, amin tác dụng với axit sinh ra muối amoni. Ví dụ:CH3NH2 + H2SO4 → (CH3NH3)2SO4 (Metylamoni sulfat)
- Các amin có tính bazơ mạnh hơn sẽ đẩy được những amin có tính bazơ yếu hơn hoặc những bazơ yếu thoát khỏi muối của nó. Ví dụ:
CuCl2 + 2CH3NH2 + 2H2O → 2[CH3NH3⌋Cl + Cu(OH)2 ↓
Amin bậc một dãy béo tác dụng với axit nitrơ tạo thành ancol tương ứng và giải phóng khí N2
C2H5NH2 + HONO → C2H5OH + N2 + H2O (xúc tác HCl)Amin bậc hai dãy béo cũng như dãy thơm đều tác dụng với axit nitrơ sinh ra nitrosamin (nitrosoamin) là những chất màu vàng, nhờ đó phân biệt được amin bậc hai với amin bậc một:
(CH3)2NH + HONO → (CH3)2N-N=O + H2OAmin bậc 3 dãy béo không tác dụng với axit nitrơ hoặc chỉ tạo thành muối không bền dễ bị thủy phân
- Ankyl hóa amoniac và amin bậc thấp hơn:
Dẫn xuất halogen tác dụng với amoniac và với amin tạo thành một hỗn hợp amin có bậc rất khác nhau và muối amoni bậc bốn. Nếu trong sơ đồ diều chế dùng dư amoniac, amin bậc một chiếm ưu thế. Điều chế riêng amin bậc một (không lẫn amin bậc cao hơn), người ta ankyl hóa kali phtalimit rồi thủy phân thành phầm.
Ví dụ 1:Bậc amin là
A. bậc của nguyên tử C link với chức amin.
B. bậc của nguyên tử N trong chức amin.
C. số gốc hiđrocacbon link với nguyên tử nitơ của amin.
D. số nguyên tử H của NH3 đã biết thành thay thế bởi gốc hiđrocacbon..
Ví dụ 2: Chất nào sau này là amin bậc 2 ?
A. H2N-CH2-NH2 . B. (CH3)2CH-NH2. C. CH3-NH-CH3. D. (CH3)3N.
Ví dụ 3: Chất nào sau này thuộc loại amin bậc 3 ?
A. (CH3)3N. B. CH3-NH2. C. C2H5-NH2. D. CH3-NH-CH3
I- Khái niệm, phân loại, danh pháp, đồng phân
1. Khái niệm
– Khi thay thế một hay nhiều nguyên tử H trong phân tử NH3 bằng một hay nhiều gốc hiđrocacbon ta được amin.
– Trong phân tử amin, nguyên tử nitơ tạo được một hoặc 2 hoặc 3 link với nguyên tử cacbon của gốc hiđrocacbon.
2. Phân loại
a. Theo đặc điểm cấu trúc gốc hiđrocacbon
Amin thơm (anilin C6H5NH2), amin béo (etylamin C2H5NH2), amin dị vòng.
b. Theo bậc amin
Amin bậc I
Amin bậc II
Amin bậc III
R – NH2

R, R’, R” là gốc hiđrocacbon
3. Danh pháp
Tên của amin được gọi theo danh pháp gốc – chức và danh pháp thay thế, một số trong những amin được gọi theo tên thông thường (tên riêng).
a. Theo danh pháp gốc – chức
Tên amin = tên gốc hiđrocacbon + amin
Ví dụ:

b. Theo danh pháp thay thế
Tên amin = tên ankan + vị trí + amin
Ví dụ:

Lưu ý: Nhóm NH2 khi đóng vai trò nhóm thế gọi là nhóm amino, khi đóng vai trò nhóm chức thì gọi là nhóm amin.
– Tên của một số trong những amin: C6H5NH2: phenylamin hoặc benzenamin
C6H5CH2NH2: benzylamin

– Tên của amin bậc II đối xứng là điankylamin:

– Tên của amin bậc III đối xứng là triankylamin:

4. Đồng phân
Amin thường có đồng phân về mạch cacbon, vị trí nhóm chức amin và bậc của amin. Khi viết công thức cấc đồng phân cấu trúc của amin , cần viết đồng phân mạch C và đồng phân vị trí nhóm chức cho từng loại: amin bậc I, amin bậc II, amin bậc III.
II- Tính chất vật lý
– Metylamin (CH3NH2), đimetylamin (CH3NHCH3), trimetylamin ((CH3)3N) và etylamin (C2H5NH2) là những chất khí, mùi rất khó chịu, độc dễ tan trong nước.
– Anilin (C2H5NH2) là chất lỏng, sôi ở 184°C, không màu, rất độc, ít tan trong nước. Để lâu trong không khí anilin chuyển sang màu nâu đen.
III- Công thức phân tử của amin
– Amin đơn chức : CxHyN hay RNH2
– Amin đơn chức no: CnH2n+1NH2 hay CnH2n+3N ( n≥1)
– Amin đa chức no: CnH2n+2-x(NH2)x hay CnH2n+2+xNx
IV- Tính chất hóa học
Trong phân tử amin có nguyên tử nitơ còn đôi electron chưa link (tương tự như trong phân tử amoniac) nên amin thể hiện tính bazơ.

1. Tính bazơ
– Tương tự như NH3 những amin đều phải có tính bazơ, tan trong nước làm xanh quỳ tím
CH3NH2 + HOH
 CH3NH3+ + OH-
CH3NH3+ + OH-
– Tính bazơ của amin càng mạnh khi có nhóm ankyl (CH3 -, C2H5 -, C3H7 – …) nhóm đẩy điện tử. Nhóm ankyl có ảnh hưởng làm tăng tỷ suất electron của nguyên tử nitơ do đó làm tăng lực bazơ.
– Tính bazơ của amin càng yếu khi có nhóm hút electron (như C6H5 -, CH2 = CH-,…) nhóm này làm giảm tỷ suất electron của nguyên tử nitơ nên giảm lực bazơ.

– Anilin và những amin thơm (C6H5NHCH3: amin thơm bậc II, (CH3)2N – C6H5, amin thơm bậc III) rất ít tan trong nước. Dung dịch của chúng không làm đổi màu quỳ tím và phenolphtalein.
2. Tác dụng với axit sinh ra muối amoni
CH3NH2(hơi) + HCl(hơi) → [CH3NH3]+Cl-
metylamoni clorua
2CH3CH2NH2 + H2SO4 → (CH3CH2NH3)2SO4
CH3NH2 + HNO3 → CH3NH3NO3
C6H5NH2 + HCl → C6H5NH3+Cl-
(phenylamoni clorua)
Tuy vậy, vì amin là những bazơ yếu nên những muối này thuận tiện và đơn thuần và giản dị tác dụng với kiềm giải phóng amin, thí dụ:
C6H5NH3+Cl- + NaOH → C6H5NH2 + NaCl + H2O
3. Tác dụng với dung dịch muối của một số trong những sắt kẽm kim loại tạo ra kết tủa hiđroxit tương ứng.
3CH3NH2 + 3H2O + FeCl3 → Fe(OH)3 + 3 CH3NH3Cl
4. Phản ứng với axit nitrơ (HNO2)
– Amin bậc I tác dụng với HNO2 ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ
– Amin những bậc rất khác nhau tác dụng với axit nitrơ theo những phương pháp rất khác nhau, nhờ đó ta hoàn toàn có thể phân biệt được những bậc amin
C2H5NH2 + HONO → C2H5OH + N2 + H2O
(CH3)2NH + HONO → (CH3)2N – N = O + H2O
(màu vàng)

(CH3)2N + HONO: Không tác dụng
– Amin bậc I dãy thơm tác dụng với HNO2 (lạnh) tạo thành muối điazoni

Muối điazoni có vai trò quan trọng trong tổng hợp hữu cơ và nhất là tổng hợp phẩm nhuộm azo.
5. Phản ứng ankyl hoá
Cho amin bậc I hoặc bậc II tác dụng với ankyl halogenua, nguyên tử H của nhóm amin hoàn toàn có thể bị thay thế bởi gốc ankyl.
Thí dụ:
C2H5NH2 + CH3I → C2H5NHCH3 + HI

6. Phản ứng thế ở nhân thơm của anilin
– Các nhóm NH2, NHCH3… là những nhóm hoạt hóa nhân thơm và khuynh hướng những phản ứng thế vào vị trí ortho và para.
– Tương tự như phenol, anilin tác dụng với nước brom tạo thành kết tủa trắng 2, 4, 6 – tribromanilin.

Phản ứng này dùng để nhận ra anilin
7. Phản ứng cháy
CH3NH2 + 9/4O2 → CO2 +5/2 H2O +1/2 N2
V- Điều chế amin
1. Thế nguyên tử H của phân tử amoniac

Với những tỉ lệ số mol rất khác nhau, hoàn toàn có thể cho amin bậc I, II, III.

C6H5NO2 + 3Fe + 6HCl → C6H5NH2 + 3FeCl2 + 2H2O
Đặc biệt điều chế anilin từ benzen:

VI. Phương pháp giải bài tập về amin
1. Bài tập lí thuyết: So sánh tính bazơ của những amin
Tính bazơ của những amin tùy từng sự linh động của cặp elecctron tự do trên nguyên tử Nitơ.
+ Các nhóm đẩy e ( gốc ankyl) làm tăng tính bazơ
+ Các nhóm hút e ( gốc không no, thơm…) làm giảm tính bazơ
Do đó, tính bazơ tăng dần theo thứ tự: amin thơm< amin không no< NH3 < amin béo
amin béo bậc I< amin béo bậc II
Riêng tính bazơ của những amin béo bậc III còn tùy từng nhiều yếu tố rất khác nhau trong số đó có ảnh hưởng hiệu ứng không khí của những gốc R.
2. Tính số đồng phân
Số đồng phân của amin no, đơn chức: 2n-1 ( n là số nguyên tử C)
Số đồng phân amin no, đơn chức, bậc I: 2n-12
– Bậc của amin được xem bằng bậc của nguyên tố N ( Tính nhanh= 3-số nguyên tử H trên N)
3. Bài tập đốt cháy amin
– Công thức tổng quát của một amin: CnH2n+2-2k+aNa ( k: tổng số link π và số vòng trong phân tử; k≥0; a: số nhóm chức amin, a≥1; a, k đều nguyên).
– Với a=0, k=1 ta có Amin no, đơn chức, mạch hở : CnH2n+3N
Khi đó: namin = 2.nN2; số C=nCO2namin; số H=2nH2Onamin
– Amin đơn chức: CxHyN
Phương pháp giải bài tập đốt cháy amin: sử dụng định luật bảo toàn nguyên tố để tìm công thức của amin sẽ nhanh hơn so với việc lập tỉ lệ mol nC: nH: nN. Đối với bài toán đốt cháy hỗn hợp những amin thì sử dụng công thức trung bình. Đối với bài tập đốt cháy amin bằng hỗn hợp O2 và O3 thì nên quy đổi hỗn hợp thành O.
4. Bài tập amin tác dụng với axit
– Sử dụng công thức của amin dạng CnH2n+1NH2 hoặc RNH2
– Từ tỉ lệ nH+namin →số nhóm chức amin.
– Tăng giảm khối lượng: nHCl=mmuối-mamin36,5
Phương pháp giải bài tập dạng này hầu hết dùng định luật bảo toàn khối lượng. mmuối = mamin + maxit.
5. Bài tập amin tác dụng với dung dịch muối
– Đặt công thức amin là RNH2
– Chú ý tỉ lệ số mol của amin và những muối cũng như kết tủa sinh ra
2RNH2 + MgCl2 +2 H2O →Mg(OH)2 + 2RNH3Cl
6. Phản ứng của muối amoni với dung dịch kiềm
Một số vấn đề cần lưu ý:
+ Dấu hiệu để xác lập một hợp chất là muối amoni đó là: khi hợp chất đó phản ứng với dung dịch kiềm thấy giải phóng khí hoặc giải phóng khí làm xanh giấy quỳ.
+ Các loại muối amoni gồm:
– Muối amoni của amin hoặc NH3 với axit vô cơ như HCl, HNO3, H2SO4, H2CO3…muối amoni của amin no với HNO3 có công thức là C2H2n+4O3N2, muối amoni của amin no và axit sunfuric có 2 dạng : muối axit: CnH2n+5O4NS; muối trung hòa: CnH2n+8O4N2S; muối amoni của amin no với axit cacbonic có 2 dạng: muối axit: CnH2n+3O3N; muối trung hòa: CnH2n+6O3N2
+ Muối amoni của amin hoặc NH3 với axit hữu cơ như HCOOH, CH3COOH… Muối amoni của amin no với axit no, đơn chức có công thức là CnH2n+3O2N; Muối amoni của amin no với axit không no, đơn chức, phân tử có một link đôi có công thức là CnH2n+1O2N
Để làm tốt được dạng bài này thì điều quan trọng là cần xác lập được công thức của muối amoni. Sau đó viết phương trình tính toán lượng chất mà đề bài yêu cầu.




Share Link Down Công thức tổng quát của amin bậc 2 miễn phí
Bạn vừa đọc tài liệu Với Một số hướng dẫn một cách rõ ràng hơn về Review Công thức tổng quát của amin bậc 2 tiên tiến và phát triển nhất và ShareLink Tải Công thức tổng quát của amin bậc 2 Free.

Giải đáp vướng mắc về Công thức tổng quát của amin bậc 2
Nếu sau khi đọc nội dung bài viết Công thức tổng quát của amin bậc 2 vẫn chưa hiểu thì hoàn toàn có thể lại phản hồi ở cuối bài để Mình lý giải và hướng dẫn lại nha
#Công #thức #tổng #quát #của #amin #bậc