Mẹo Hướng dẫn Cân bằng phản ứng oxi hóa khử lớp 8 Mới Nhất
You đang tìm kiếm từ khóa Cân bằng phản ứng oxi hóa khử lớp 8 được Update vào lúc : 2022-12-02 18:26:09 . Với phương châm chia sẻ Kinh Nghiệm Hướng dẫn trong nội dung bài viết một cách Chi Tiết Mới Nhất. Nếu sau khi Read tài liệu vẫn ko hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Ad lý giải và hướng dẫn lại nha.
Vậy cân đối phương trình hóa học riêng với phản ứng Oxi hóa – Khử bằng phương pháp thăng bằng electron nhờ vào nguyên tắc nào? toàn bộ chúng ta cùng ôn lại trong nội dung bài viết này và giải những bài tập cân đối phương trình hóa học, phản ứng oxi hóa khử bằng phương pháp thăng bằng electron để làm rõ hơn nội dung này.
I. Phương pháp thăng bằng electron
– Để cân đối phương trình phản ứng hóa học bằng phương pháp thăng bằng electron điều quan trọng số 1 là toàn bộ chúng ta phải xác lập được số oxi hóa của những nguyên tố tham gia phản ứng oxi hóa – khử. Dưới đấy là những quy tắc xác lập số Oxi hóa của những nguyên tố tham gia phương trình phản ứng oxi hóa khử.
1.Quy tắc xác lập số Oxi hóa trong phản ứng Oxi hóa khử.
Quy tắc 1:Số oxi hóa của những nguyên tố trong đơn chất bằng 0.
Quy tắc 2:Trong hầu hết những hợp chất:
– Số oxi hóa của H là +1 (trừ những hợp chất của H với sắt kẽm kim loại như NaH, CaH2, thì H có số oxi hóa1).
– Số oxi hóa của O là2 (trừ một số trong những trường hợp như H2O2, F2O, oxi có số oxi hóa lần lượt là:1, +2).
Quy tắc 3:Trong một phân tử, tổng đại số số oxi hóa của những nguyên tố bằng 0. Theo quy tắc này, ta hoàn toàn có thể tìm kiếm được số oxi hóa của một nguyên tố nào đó trong phân tử nếu biết số oxi hóa của những nguyên tố còn sót lại.
Quy tắc 4:Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng đại số số oxi hóa của những nguyên tử trong ion đó bằng điện tích của nó.
>Chú ý:
– Để màn biểu diễn số oxi hóa thì viếtdấu trước, số sau, còn để màn biểu diễn điện tích của ion thì viết số trước, dấu sau. Ví dụ: Số oxi hóa Fe+3 còn ion sắt (III) ghi Fe3+.
– Nếu điện tích là một trong+ (hoặc 1) hoàn toàn có thể viết đơn thuần và giản dị là + (hoặc -) thì riêng với số oxi hóaphải viết khá đầy đủ cả dấu và chữ(+1 hoặc1).
– Trong hợp chất, số oxi hóa của sắt kẽm kim loại kiềm luôn là +1, kiềm thổ luôn là +2 và nhôm luôn là +3.
2. Phương pháp thăng bằng electron cân đối phương trình phản ứng oxi hóa khử
– Để lập phương trình phản ứng oxi hoá – khử theo phương pháp thăng bằng electron, ta thực thi tiến trình sau này:
* Ví dụ 1:Lập PTHH của phản ứng P cháy trong O2tạo thành P2O5theo phương trình:
P + O2 P2O5
Bước 1:Xác định số oxi hoá của những nguyên tố trong phản ứng để tìm chất oxi hoá và chất khử.
ightarrow overset+5P_2overset-2O_5" src="https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604817594rmn08yx9r4.gif"/>
Bước 2:Viết quy trình oxi hoá và quy trình khử, cân đối mỗi quy trình.
ightarrow overset+5P+5e" src="https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604817594spmdlwmxrq.gif"/>(quy trình oxi hoá)
ightarrow 2overset-2O" src="https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604817594irvbx71wio.gif"/> (quy trình khử)
Bước 3:Tìm thông số thích hợp cho chất oxi hoá và chất khử, sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hoá nhận.
ightarrow 2overset+5P +5e imes 4&| &overset0O_2+4e
ightarrow 2overset-2O endmatrix" src="https://cdc.boxhoidap.com/storecdc/can-bang-phan-ung-oxi-hoa-khu-lop-8--165d937fd3ee8fd4fc793c8114a279c8.wepb"/>
Bước 4:Đặt những thông số của chất oxi hoá và chất khử vào sơ đồ phản ứng, tính những thông số của những chất khác, kiểm tra sự cân đối của những nguyên tử của những nguyên tố ở hai vế,hoàn thành xong phương trình hoá học.
4P + 5O2 2P2O5
* Ví dụ 2:Lập PTHH của cacbon monooxit khử sắt (III) oxit ở nhiệt độ cao, thành sắt và cacbon đioxit theo PTPƯ sau:
Fe2O3+ COightarrow" src="https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604796537u20s1g2jof_1604815582_1604817595.gif"/>Fe + CO2
Bước 1:Xác định số oxi hoá
ightarrow overset0Fe+overset+4Coverset-2O_2" src="https://cdc.boxhoidap.com/storecdc/can-bang-phan-ung-oxi-hoa-khu-lop-8--0b01c4e34f9870674ab7865e1b26b7b5.wepb"/>
– Số oxi hoá của Fe giảm từ +3 xuống 0 Fe trong Fe2O3là chất oxi hoá
– Số oxi hoá của C tăng từ +2 lên +4 C trong COlà chất khử
Bước 2:Viết quy trình oxi hoá và quy trình khử
ightarrow overset0Fe" src="https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604817595c95po1c415.gif"/>
ightarrow overset+4C+2e" src="https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604817595l293hphbjs.gif"/>
Bước 3:Tìm thông số thích hợp cho chất oxi hoá và chất khử
ightarrow overset0Fe imes 3&| &overset+2C
ightarrow overset+4C+2e endmatrix" src="https://cdc.boxhoidap.com/storecdc/can-bang-phan-ung-oxi-hoa-khu-lop-8--c96579ab9f977ffeb804c4a5753e7009.wepb"/>
Bước 4:Đặt những thông số của chất oxi hoá và chất khử vào sơ đồ phản ứng, hoàn thành xong PTHH.
Fe2O3+ 3CO 2Fe + 3CO2
* Ví dụ 3: Cân bằng phương trình phản ứng Oxi hóa khử:
a) Fe + HNO3 Fe(NO3)2 + NO + H2O
b) Fe + HNO3 Fe(NO3)2+ NO2 + H2O
* Hướng dẫn:
a) Fe + HNO3 Fe(NO3)2+ NO + H2O
b) Fe + HNO3 Fe(NO3)2+ NO2+ H2O
* Ví dụ 4:Cân bằng phương trình phản ứng Oxi hóa khử:
a) Zn + HNO3 Zn(NO3)2+ NO + H2O
b) Zn + HNO3 Zn(NO3)2+ NO2+ H2O
* Hướng dẫn:
a) Zn+ HNO3 Zn(NO3)2+ NO + H2O
b) Zn + HNO3 Zn(NO3)2+ NO2+ H2O
II. Bài tập cân đối phương trình phản ứng Oxi hóa khử bằng phương phápthăngbằng electron
> Lưu ý: Với phản ứng Oxi hóa khử, cần nhớ:
– Khử cho O nhận
– Tên của chất và tên quy trình ngược nhau
– Chất khử là chất sẽ nhường electron (hay cho e) – đó quy trình oxi hóa.
– Chất oxi hóa là chất mà thu electron (hay nhận e) – đó là quy trình khử.
* Bài 1(Bài 7 trang 83 sgk hóa 10):Lập phương trình phản ứng oxi hóa khử sau này theo phương pháp thăng bằng electron:
a) Cho MnO2tác dụng với dung dịch axit HCl đặc, thu được MnCl2, Cl2và H2O.
b) Cho Cu tác dụng với dung dịch axit HNO3đặc, nóng thu được Cu(NO3)2, NO2, H2O.
c) Cho Mg tác dụng với dung dịch axit H2SO4đặc, nóng thu được MgSO4, S và H2O.
Lời giải:
a)Ta có PTHH:
MnO2+ HClđặc MnCl2+ Cl2 +H2O
– Thực hiện tiến trình cân đối PTHH bằng phương pháp thăng bằng electron.
ightarrow overset+2Mnoverset-1Cl_2+overset0Cl_2+H_2O" src="https://cdc.boxhoidap.com/storecdc/can-bang-phan-ung-oxi-hoa-khu-lop-8--76966c8937085bc64c0a98c52535cffd.wepb"/>
ightarrow overset+2Mn imes 1&| &2overset-1Cl
ightarrow overset0Cl_2+2e endmatrix" src="https://storecda.boxhoidap.com/storecda/can-bang-phan-ung-oxi-hoa-khu-lop-8--620787a297ffd7e4ca80595d0cb0ded2.wepb"/>
-Phương trình phản ứng được cân đối như sau:
MnO2+ 4HClđặc MnCl2+ Cl2 +2H2O
b) Ta có PTHH:
Cu + HNO3đặc, nóng Cu(NO3)2+ NO2 + H2O
– Thực hiện cân đối bằng phương pháp electron.
ightarrow overset+2Cu(NO_3)_2+overset+4NO_2+H_2O" src="https://cdc.boxhoidap.com/storecdc/can-bang-phan-ung-oxi-hoa-khu-lop-8--09b1b363a546456c667258c9840e8a5c.wepb"/>
ightarrow overset+2Cu+2e imes 2&| &overset+5N+1e
ightarrow overset+4Nendmatrix" src="https://storecda.boxhoidap.com/storecda/can-bang-phan-ung-oxi-hoa-khu-lop-8--0c8cd658f3f7ad70601a3f57c6b5267c.wepb"/>
-Phương trình phản ứng được cân đối như sau:
Cu + 4HNO3đặc, nóng Cu(NO3)2+ 2NO2 + 2H2O
c)Ta có PTHH:
Mg + H2SO4 đặc, nóng MgSO4+ S+ H2O
– Phương trình hoá học sau khi cân đối như sau:
ightarrow 3overset+2MgSO_4+overset0S+4H_2O" src="https://cdc.boxhoidap.com/storecdc/can-bang-phan-ung-oxi-hoa-khu-lop-8--4dc6889521d7cc826de4cfdbec3eaa56.wepb"/>
ightarrow overset+2Mg+2e imes 1&| &overset+6S+6e
ightarrow overset0Sendmatrix" src="https://jp.boxhoidap.com/boxfiles/can-bang-phan-ung-oxi-hoa-khu-lop-8--7474dd64f1870dd6738361818bc2bde5.wepb"/>
* Bài 2: Cân bằng những phản ứng oxi hóa khử sau:
a) NH3 + O2NO + H2O
b) Mg + HNO3 Mg(NO3)2 + NH4NO3 + H2O
c) Zn + H2SO4ZnSO4 + H2S + H2O
d) MnO2 + HCl MnCl2+ Cl2 + H2O
e) KMnO4+ HCl KCl + MnCl2+ Cl2 + H2O
f) KMnO4+ FeSO4+ H2SO4 Fe2(SO4)3 + MnSO4+ K2SO4+ H2O
g) KMnO4+ K2SO3+ H2O K2SO4+ MnO2+ KOH
h) FeO + HNO3 Fe(NO3)3+ N2O + H2O
* Hướng dẫn:
a) NH3 + O2 NO + H2O
– Ta xác lập sự thay đổi số oxi hóa, và thăng bằng số electron
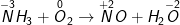
– Ta được phương trình sau khi cân đối như sau:
b) Mg + HNO3 Mg(NO3)2 + NH4NO3 + H2O
– Ta được phương trình sau khi cân đối như sau:
Bài 3: Cân bằng những phản ứng Oxi hóa – Khử sau:
a) KClO3 ![xrightarrow[]t^0](https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604815647ev6c0mjp6b_1604817601.gif) KCl + O2
KCl + O2
b) AgNO3 ![xrightarrow[]t^0](https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604815647ev6c0mjp6b_1604817601.gif) Ag + NO2 + O2
Ag + NO2 + O2
c) Cu(NO3)2![xrightarrow[]t^0](https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604815647ev6c0mjp6b_1604817601.gif) CuO + NO2 + O2
CuO + NO2 + O2
d) HNO3![xrightarrow[]t^0](https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604815647ev6c0mjp6b_1604817601.gif) NO2 + O2 + H2O
NO2 + O2 + H2O
e) KMnO4 ![xrightarrow[]t^0](https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604815647ev6c0mjp6b_1604817601.gif) K2MnO4 + O2 + MnO2
K2MnO4 + O2 + MnO2
Lời giải:
a) KClO3![xrightarrow[]t^0](https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604815647ev6c0mjp6b_1604817601.gif) KCl + O2
KCl + O2
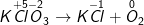
– Ta được: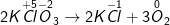
b) AgNO3![xrightarrow[]t^0](https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604815647ev6c0mjp6b_1604817601.gif) Ag + NO2 + O2
Ag + NO2 + O2
– Ta được:
* Bài 4: Cân bằng những phản ứng oxi hóa khử sau:
a)Cl2 + KOH KCl + KClO3 + H2O
b) S + NaOH Na2S + Na2SO3 + H2O
c) NH4NO2 N2 + H2O
d) I2 + H2O HI + HIO3
* Bài 5: Cân bằng những phản ứng oxi hóa khử sau:
a)Fe3O4 + HNO3 Fe(NO3)3 + NO + H2O
b)FeS2 + O2 Fe2O3 + SO2
c)FeS + KNO3 KNO2 + Fe2O3 + SO3
d) FeS2+ HNO3 Fe(NO3)3 + H2SO4+ NO2 + H2O
e) FeS2+ HNO3+ HCl FeCl3+ H2SO4+ NO + H2O
f) FeS + HNO3 Fe(NO3)3 + Fe2(SO4)3+ NO + H2O
g)Cu2S + HNO3 NO + Cu(NO3)2 + CuSO4 + H2O
h)FeS + H2SO4 Fe2(SO4)3 + S + SO2 + H2O
* Bài 6: Cân bằng những phản ứng oxi hóa khử:
a)M + HNO3 M(NO3)n + NO2 + H2O (Với M là sắt kẽm kim loại hoá trị n)
– Thay NO2 lần lượt bằng: NO, N2O, N2, NH4NO3rồi hoàn thành xong phản ứng.
b) M + H2SO4 M2(SO4)n + SO2 + H2O
c)FexOy + HNO3 Fe(NO3)3 + NO + H2O
– Thay NO lần lượt bằng NO2, N2O, N2, NH4NO3rồi hoàn thành xong phản ứng.
d)FexOy+ H2SO4 Fe2(SO4)3 + SO2 + H2O
e) FeO + HNO3 Fe(NO3)3 + NxOy + H2O
Reply
6
0
Chia sẻ
Chia Sẻ Link Cập nhật Cân bằng phản ứng oxi hóa khử lớp 8 miễn phí
Bạn vừa Read nội dung bài viết Với Một số hướng dẫn một cách rõ ràng hơn về Review Cân bằng phản ứng oxi hóa khử lớp 8 tiên tiến và phát triển nhất và ShareLink Tải Cân bằng phản ứng oxi hóa khử lớp 8 miễn phí.

Giải đáp vướng mắc về Cân bằng phản ứng oxi hóa khử lớp 8
Nếu sau khi đọc nội dung bài viết Cân bằng phản ứng oxi hóa khử lớp 8 vẫn chưa hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Admin lý giải và hướng dẫn lại nha
#Cân #bằng #phản #ứng #oxi #hóa #khử #lớp