Kinh Nghiệm về Đề bài – đề số 5 – đề kiểm tra giữa kì ii – hóa học 9 có lời giải Chi Tiết
Bạn đang tìm kiếm từ khóa Đề bài – đề số 5 – đề kiểm tra giữa kì ii – hóa học 9 có lời giải được Update vào lúc : 2022-02-21 09:55:01 . Với phương châm chia sẻ Bí quyết Hướng dẫn trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi đọc tài liệu vẫn ko hiểu thì hoàn toàn có thể lại Comments ở cuối bài để Ad lý giải và hướng dẫn lại nha.
Câu 35 : Hỗn hợp X gồm Al, Fe2O3, Fe3O4, CuO (trong số đó oxi chiếm 25,39% về khối lượng hỗn hợp). Cho m gam hỗn hợp X tác dụng với 8,96 lít khí CO (ở đktc) sau thuở nào gian thu được hỗn hợp rắn Y và hỗn hợp khí Z có tỉ khối so với hiđro là 19. Cho hỗn hợp Y tác dụng với dung dịch HNO3 loãng dư thu được dung dịch T và 7,168 lít khí NO (ở đktc, thành phầm khử duy nhất). Cô cạn T thu được 3,456m gam muối khan. Giá trị của m sớm nhất với giá trị nào sau này?
Đề bài
Câu 1 : Cho những chất sau: phenylamoni clorua, anilin, glyxin, ancol benzylic, metyl axetat. Số chất phản ứng được với dung dịch KOH là
A. 4. B. 2.
C. 1. D. 3.
Câu 2 : Kim loại nào sau này có khối lượng riêng lớn số 1?
A. Fe. B. Pb.
C. Ag. D. Os.
Câu 3 : Kim loại sắt không phản ứng được với dung dịch nào sau này?
A. ZnCl2. B. FeCl3.
C. H2SO4 loãng, nguội. D. AgNO3.
Câu 4 : Crom(III) hiđroxit tan trong dung dịch nào sau này?
A. KCl. B. NaOH.
C. KNO3. D. NaCrO2.
Câu 5 : Phản ứng nào sau này là phản ứng trao đổi ion trong dung dịch?
A. Mg + H2SO4 MgSO4 + H2.
B. Fe(NO3)3 + 2KI Fe(NO3)2 + I2 + 2KNO3.
C. Fe(NO3)3 + 3NaOH Fe(OH)3 + 3NaNO3.
D. Cu + 2FeCl3 CuCl2 + 2FeCl2.
Câu 6 : Chất nào sau này có tính lưỡng tính?
A. Valin. B. Metylamin.
C. Etylamin. D. Anilin.
Câu 7 : Thủy phân 68,4 gam saccarozơ trong môi trường tự nhiên vạn vật thiên nhiên axit với hiệu suất 92%, sau phản ứng thu được dung dịch chứa m gam glucozơ. Giá trị của m là
A. 33,12. B. 66,24.
C. 72,00. D. 36,00.
Câu 8 : Este nào sau này là no, đơn chức, mạch hở?
A. CH3COOC6H5. B. HCOOCH=CH2.
C. CH3COOCH3. D. (HCOO)2C2H4.
Câu 9 : Chất bột X red color, được quét lên phía ngoài của vỏ bao diêm. Chất X là
A. Kali nitrat. B. Photpho.
C. Lưu huỳnh. D. Đá vôi.
Câu 10 : Chất hữu cơ X thuộc loại cacbohiđrat là chất rắn, white color, không tan trong nước, dạng nguyên chất hay gần nguyên chất, được chế thành sợi, tơ, giấy viết. Chất X là
A. xenlulozơ. B. tinh bột.
C. saccarozơ. D. tristearin.
Câu 11 : Cho 86,3 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong số đó oxi chiếm 19,47% về khối lượng) tan hết vào nước thu được dung dịch Y và 13,44 lít H2 (đktc). Cho 3,2 lít dung dịch HCl 0,75M vào dung dịch Y, thu được m gam kết tủa. Giá trị của m là
A. 54,6. B. 27,3.
C. 23,4. D. 10,4.
Câu 12 : Metylamin phản ứng với dung dịch chất nào sau này?
A. Ca(OH)2. B. NH3.
C. CH3COOH. D. NaCl.
Câu 13 : Thí nghiệm nào sau này xẩy ra ăn mòn điện hóa?
A. Cho lá sắt nguyên chất vào dung dịch gồm CuSO4 và H2SO4 loãng.
B. Nhúng thanh kẽm nguyên chất vào dung dịch HCl.
C. Để thanh thép đã được phủ sơn kín trong không khí khô.
D. Cho lá đồng nguyên chất vào dung dịch gồm Fe(NO3)3 và HNO3.
Câu 14 : Cho luồng khí H2 dư qua hỗn hợp những oxit CuO, Fe2O3, Al2O3, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn thu được gồm
A. Cu, Fe, Al, Mg.
B. Cu, Fe, Al2O3, MgO.
C. Cu, Fe, Al, MgO.
D. Cu, FeO, Al2O3, MgO.
Câu 15 : Dung dịch chứa chất nào sau này không làm đổi màu quỳ tím?
A. Axit amino axetic. B. Metylamin.
C. Axit glutamic. D. Lysin.
Câu 16 : Kim loại nào sau này được điều chế bằng phản ứng thủy luyện?
A. Na. B. Mg.
C. Cu. D. Al.
Câu 17 : Cho 16,1 gam hỗn hợp X gồm CaCO3 và MgCO3 (có tỉ lệ mol 1 : 1) tan hết trong dung dịch HCl dư, thu được V lít (đktc) khí CO2. Giá trị của V là
A. 7,84. B. 2,94.
C. 3,92. D. 1,96.
Câu 18 : Thủy phân hoàn toàn đisaccarit A thu được hai monosaccarit X và Y. Hiđro hóa X hoặc Y đều thu được chất hữu cơ Z. A và Z lần lượt là
A. Saccarozơ và glucozơ.
B. Glucozơ và sobitol.
C. Tinh bột và glucozơ.
D. Saccarozơ và sobitol.
Câu 19 : Cho những polime sau: polietilen, poli(vinyl clorua), cao su lưu hóa, nilon-6,6, amilopectin, xenlulozơ. Số polime có cấu trúc mạch không phân nhánh là
A. 5. B. 3.
C. 6. D. 4.
Câu 20 : Chất nào sau này là polisaccarit?
A. Tinh bột. B. Glucozơ.
C. Saccarozơ. D. Fructozơ.
Câu 21 : Este X mạch hở có công thức phân tử C5H8O2. Khi đun nóng X với dung dịch NaOH, thu được muối của axit cacboxylic và ancol no. Số đồng phân của X thỏa mãn nhu cầu là
A. 6. B. 5.
C. 3. D. 4.
Câu 22 : Cho 10,7 gam hỗn hợp X gồm Al và MgO vào dung dịch NaOH dư, sau khi phản ứng xẩy ra hoàn toàn, thu được 3,36 lít khí H2 (đktc). Khối lượng MgO trong X là
A. 2,7 gam. B. 4,0 gam.
C. 8,0 gam. D. 6,0 gam.
Câu 23 : Khi cho dung dịch anbumin (protein lòng trắng trứng) tác dụng với Cu(OH)2 thì thu được dung dịch có màu gì?
A. vàng. B. tím.
C. đỏ. D. trắng.
Câu 24 : Cho 50 ml dung dịch FeCl2 1M vào dung dịch AgNO3 dư, sau khi những phản ứng xẩy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
A. 18,15. B. 14,35.
C. 15,75. D. 19,75.
Câu 25 : Cho 2,52 gam sắt kẽm kim loại M tác dụng với dung dịch H2SO4 loãng, vừa đủ, sau phản ứng thu được 6,84 gam muối sunfat trung hòa. Kim loại M là
A. Zn. B. Ca.
C. Fe. D. Mg.
Câu 26 : Thủy phân hợp chất: H2N-CH(CH3)-CONH-CH2-CONH-CH2-CH2-CONH-CH(C6H5)-CONH-CH(CH3)-COOH thì số α-amino axit thu được là
A. 4. B. 2.
C. 5. D. 3.
Câu 27 : Cho 1 mol X tác dụng tối đa 1 mol Br2. X hoàn toàn có thể là chất nào sau này?
A. Metan. B. Buta-1,3-đien.
C. Etilen. D. Axetilen.
Câu 28 : Loại tơ nào sau này có nguồn gốc từ xenlulozơ?
A. Tơ visco. B. Tơ tằm.
C. Tơ nilon-6,6. D. Tơ olon.
Câu 29 : Cho a gam hỗn hợp X gồm glyxin, alanin và valin phản ứng với 100 ml dung dịch HCl 1M thu được dung dịch Y. Để phản ứng hết với những chất trong dung dịch Y cần 380 ml dung dịch KOH 0,5M. Mặt khác, đốt cháy hoàn toàn a gam hỗn hợp X rồi cho thành phầm cháy vào trong bình đựng dung dịch Ba(OH)2 dư, sau phản ứng khối lượng dung dịch trong bình giảm 43,74 gam. Giá trị của a là
A. 7,57. B. 8,85.
C. 7,75. D. 5,48.
Câu 30 : Cho tiến trình tiến hành thí nghiệm tráng bạc của glucozơ:
(1) Thêm 3 – 5 giọt glucozơ vào ống nghiệm.
(2) Nhỏ từ từ dung dịch NH3 cho tới lúc kết tủa tan hết.
(3) Đun nóng nhẹ hỗn hợp ở 60 – 70°C trong vài phút.
(4) Cho 1 ml dung dịch AgNO3 1% vào ống nghiệm sạch.
Thứ tự tiến hành đúng là
A. (4), (2), (1), (3). B. (1), (4), (2), (3).
C. (1), (2), (3), (4). D. (4), (2), (3), (1).
Câu 31 : Thuỷ phân hoàn toàn a mol triglixerit X trong dung dịch NaOH vừa đủ, thu được glixerol và m gam hỗn hợp muối. Đốt cháy hoàn toàn a mol X cần vừa đủ 7,75 mol O2 và thu được 5,5 mol CO2. Mặt khác, a mol X tác dụng tối đa với 0,2 mol Br2 trong dung dịch. Giá trị của m là
A. 82,4. B. 97,6.
C. 80,6. D. 88,6.
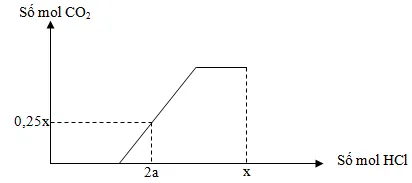
Câu 32 : Rót từ từ dung dịch HCl vào dung dịch hỗn hợp X chứa a mol K2CO3 và 1,25a mol KHCO3 ta có đồ thị như hình bên. Khi số mol HCl là x thì dung dịch chứa 97,02 gam chất tan. Giá trị của a là
A. 0,24. B. 0,20.
C. 0,18. D. 0,36.
Câu 33 : Cho hỗn hợp E gồm X (C6H16O4N2 là muối của axit hai chức) và Y (C9H23O6N3, là muối của axit glutamic) tác dụng hoàn toàn với dung dịch KOH thu được 7,392 lít (đktc) hỗn hợp hai amin no (tiếp theo đó trong dãy đồng đẳng, có tỉ khối so với H2 là 107/6) và dung dịch T. Cô cạn T, thu được m gam hỗn hợp G gồm ba muối khan trong số đó có 2 muối có cùng số nguyên tử cacbon trong phân tử. Giá trị của m là
A. 58,52. B. 93,83.
C. 51,48. D. 44,44.
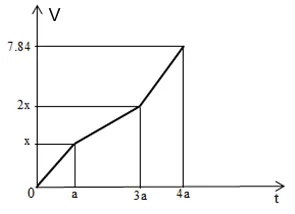
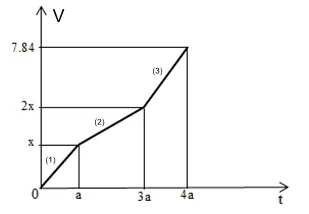
Câu 34 : Điện phân dung dịch X chứa Cu(NO3)2 và NaCl với cường độ dòng điện không đổi, điện cực trơ thấy thể tích khí thoát ra ở cả hai điện cực (V lít, đktc) và thời hạn điện phân (t giây) phụ thuộc nhau theo đồ thị hình bên.
Nếu điện phân dung dịch đến thời hạn 2a giây rồi dừng điện phân thì dung dịch sau điện phân có tổng số mol những chất tan là
A. 0,75. B. 0,50.
C. 0,80. D. 0,65.
Câu 35 : Hỗn hợp X gồm Al, Fe2O3, Fe3O4, CuO (trong số đó oxi chiếm 25,39% về khối lượng hỗn hợp). Cho m gam hỗn hợp X tác dụng với 8,96 lít khí CO (ở đktc) sau thuở nào gian thu được hỗn hợp rắn Y và hỗn hợp khí Z có tỉ khối so với hiđro là 19. Cho hỗn hợp Y tác dụng với dung dịch HNO3 loãng dư thu được dung dịch T và 7,168 lít khí NO (ở đktc, thành phầm khử duy nhất). Cô cạn T thu được 3,456m gam muối khan. Giá trị của m sớm nhất với giá trị nào sau này?
A. 38,43. B. 35,19.
C. 41,13. D. 40,43.
Câu 36 : Đốt cháy hoàn toàn 0,6 mol hỗn hợp E chứa ancol X, este đơn chức Y và anđehit Z (X, Y, Z đều no, mạch hở và có cùng số nguyên tử hiđro) có tỉ lệ mol tương ứng 3 : 1 : 2 thu được 24,64 lít CO2 (đktc) và 21,6 gam nước. Mặt khác, cho 0,6 mol hỗn hợp E trên tác dụng với dung dịch AgNO3 trong NH3 đun nóng thu được m gam Ag. Giá trị m của là
A. 97,2. B. 64,8.
C. 108. D. 86,4.
Câu 37 : Cho những phát biểu sau:
(a) Thủy phân tripanmitin và etyl axetat đều thu được ancol.
(b) Mỡ động vật hoang dã và dầu thực vật đều chứa nhiều chất béo.
(c) Hiđro hóa triolein thu được tripanmitin.
(d) Thủy phân vinyl fomat thu được hai thành phầm đều phải có phản ứng tráng bạc.
(e) Ứng với công thức đơn thuần và giản dị nhất là CH2O có 3 chất hữu cơ đơn chức, mạch hở.
Số phát biểu đúng là
A. 5. B. 4.
C. 3. D. 2.
Câu 38 : Đốt cháy hoàn toàn m gam hỗn hợp A gồm 3 este X, Y, Z (đều mạch hở và chỉ chứa chức este, Z chiếm Phần Trăm khối lượng lớn số 1 trong A) thu được lượng CO2 to nhiều hơn H2O là 0,25 mol. Mặt khác, m gam A phản ứng vừa đủ với dung dịch NaOH thu được 22,2 gam 2 ancol hơn kém nhau 1 nguyên tử cacbon và hỗn hợp T gồm 2 muối. Đốt cháy hoàn toàn T cần vừa đủ 0,275 mol O2 thu được CO2, 0,35 mol Na2CO3 và 0,2 mol H2O. Phần trăm khối lượng của Z trong A là
A. 45,20%. B. 42,65%.
C. 62,10%. D. 50,40%.
Câu 39 : Thực hiện những thí nghiệm sau:
(a) Cu vào dung dịch Fe2(SO4)3.
(b) Sục khí CO2 vào dung dịch Ca(OH)2.
(c) Sục hỗn hợp NO2 và O2 vào nước.
(d) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(e) Cho FeO vào dung dịch H2SO4 đặc, nóng.
(f) Hòa tan BaO vào nước.
Số thí nghiệm có xẩy ra phản ứng oxi hóa – khử là
A. 3. B. 4.
C. 5. D. 2.
Câu 40 : Cho những phát biểu sau:
(a) Dầu mỡ sau khi sử dụng, hoàn toàn có thể tái chế thành nhiên liệu.
(b) Muối mononatri của axit glutamic được sử dụng làm bột ngọt (mì chính).
(c) Amilopectin, tơ tằm, lông cừu là polime vạn vật thiên nhiên.
(d) Chất độn amiăng làm tăng tính chịu nhiệt của chất dẻo.
(e) Khi cho giấm ăn (hoặc chanh) vào sữa bò hoặc sữa đậu nành thì thấy có kết tủa xuất hiện.
(f) Thành phần chính của khi biogas là metan.
Số phát biểu đúng là
A. 5. B. 3.
C. 4. D. 6.
Lời giải rõ ràng
Câu 1
Phương pháp:
Những chất hữu cơ phản ứng được với dung dịch bazơ: phenol, axit cacboxylic, este, amino axit, peptit, protein, muối của amin (RNH3+),
Hướng dẫn giải:
Có 3 chất có phản ứng với dung dịch KOH:
– Phenylamoni clorua (C6H5NH3Cl):
C6H5NH3Cl + KOH C6H5NH2 + KCl + H2O
– Glyxin (H2NCH2COOH):
H2NCH2COOH + KOH H2NCH2COOK + H2O
– Metyl axetat (CH3COOCH3):
CH3COOCH3 + KOH CH3COOK + CH3OH
Đáp án D
Câu 2
Phương pháp:
Dựa vào lý thuyết chương Đại cương sắt kẽm kim loại.
Hướng dẫn giải:
Kim loại có khối lượng riêng lớn số 1 là Os.
Đáp án D
Câu 3
Theo quy tắc α, hay thấy Fe không phản ứng được với dung dịch ZnCl2.
Đáp án A
Câu 4
Phương pháp:
Dựa vào lý thuyết crom và hợp chất.
Hướng dẫn giải:
Crom(III) hiđroxit – Cr(OH)3 có tính lưỡng tính.
⟹ Cr(OH)3 tan được trong dung dịch NaOH: Cr(OH)3 + NaOH NaCrO2 + 2H2O.
Đáp án B
Câu 5
Phương pháp:
Phản ứng trao đổi ion trong dung dịch (dung dịch chất điện li) là phản ứng Một trong những ion.
Phản ứng trao đổi ion trong dung dịch có dạng:
AB + CD AD + BC
Trong số đó thành phầm phải có chất kết tủa hoặc chất bay hơi hoặc chất điện li yếu.
Hướng dẫn giải:
Phản ứng “Fe(NO3)3 + 3NaOH Fe(OH)3 + 3NaNO3” thuộc loại phản ứng trao đổi ion trong dung dịch.
Đáp án C
Câu 6
Phương pháp:
Dựa vào lý thuyết chương Amin, amino axit và protein.
Hướng dẫn giải:
Valin là amino axit có nhóm NH2 thể hiện tính bazơ và nhóm COOH thể hiện tính axit
⟹ Valin có tính lưỡng tính.
Đáp án A
Câu 7
Phương pháp:
Phản ứng thủy phân:
C12H22O11 + H2O (xrightarrowH^+) C6H12O6 + C6H12O6
glucozơ fructozơ
Tính nC12H22O11 ⟹ nglucozơ LT ⟹ nglucozơ TT = nglucozơ LT . H% ⟹ mglucozơ TT.
Hướng dẫn giải:
Phản ứng thủy phân:
C12H22O11 + H2O (xrightarrowH^+) C6H12O6 + C6H12O6
glucozơ fructozơ
nC12H22O11 = 68,4/342 = 0,2 mol.
Theo PTHH: nglucozơ LT = nC12H22O11 = 0,2 mol
⟹ nglucozơ TT = nglucozơ LT . H% = 0,2.92% = 0,184 mol
⟹ mglucozơ TT = 0,184.180 = 33,12 gam.
Đáp án A
Câu 8
Phương pháp:
Dựa vào lý thuyết este.
Hướng dẫn giải:
CH3COOCH3 thuộc loại este no, đơn chức, mạch hở.
Đáp án C
Câu 9
Hướng dẫn giải:
Photpho đỏ được quét lên phía ngoài của vỏ bao diêm.
Đáp án B
Câu 10
Phương pháp:
Dựa vào lý thuyết chương Cacbohiđrat.
Hướng dẫn giải:
Xenlulozơ là chất rắn, white color, không tan trong nước, dạng nguyên chất hay gần nguyên chất, được chế thành sợi, tơ, giấy viết,
Đáp án A
Câu 11
Phương pháp:
– Khi hỗn hợp X + H2O:
2Na + 2H2O 2NaOH + H2 (1)
2K + 2H2O 2KOH + H2 (2)
Ba + 2H2O Ba(OH)2 + H2 (3)
Al2O3 + 2OH- 2AlO2- + H2O (4)
Từ (1) (2) (3) ta thấy nOH- = 2nH2.
Tính toán theo (4) ⟹ Thành phần của dung dịch Y.
– Khi dung dịch Y + HCl thì những phản ứng xẩy ra theo thứ tự:
H+ + OH- H2O
H+ + AlO2- + H2O Al(OH)3
3H+ + Al(OH)3 Al3+ + 3H2O
Hướng dẫn giải:
Ta có mO(X) = 86,3.19,47% = 16,8 gam.
⟹ nO(X) = 16,8/16 = 1,05 mol
⟹ nAl2O3 = 1/3.nO(X) = 0,35 mol
– Khi hỗn hợp X + H2O:
nH2 = 13,44/22,4 = 0,6 mol
2Na + 2H2O 2NaOH + H2 (1)
2K + 2H2O 2KOH + H2 (2)
Ba + 2H2O Ba(OH)2 + H2 (3)
Từ (1) (2) (3) ta thấy nOH- = 2nH2 = 1,2 mol
Al2O3 + 2OH- 2AlO2- + H2O (4)
0,35 0,7 0,7 (mol)
Trong dung dịch Y có chứa: OH- dư (1,2 – 0,7 = 0,5 mol) và AlO2- (0,7 mol).
– Khi dung dịch Y + HCl thì những phản ứng xẩy ra theo thứ tự:
nH+ = 3,2.0,75 = 2,4 mol
H+ + OH- H2O
0,5 0,5 (mol)
H+ + AlO2- + H2O Al(OH)3
0,7 0,7 0,7 (mol)
nH+ còn sót lại = 2,4 – 0,5 – 0,7 = 1,2 mol
3H+ + Al(OH)3 Al3+ + 3H2O
1,2 0,4 (mol)
⟹ nAl(OH)3 còn sót lại = 0,7 – 0,4 = 0,3 mol
⟹ m = 0,3.78 = 23,4 gam.
Đáp án C
Câu 12
Phương pháp:
Dựa vào lý thuyết amin.
Hướng dẫn giải:
Metylamin (CH3NH2) hay những amin nói chung có tính bazơ.
⟹ Phản ứng được với axit: CH3NH2 + CH3COOH CH3NH3+CH3COO-.
Đáp án C
Câu 13
Phương pháp:
Điều kiện để xẩy ra ăn mòn điện hóa:
– Bản chất hai điện cực phải rất khác nhau về bản chất (KL-KL, KL-PK,)
– Hai điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau (qua dây dẫn)
– Hai điện cực phải cùng tiếp xúc với môi trường tự nhiên vạn vật thiên nhiên chất điện li
Hướng dẫn giải:
– Xét đáp án A:
Xảy ra phản ứng: Fe + CuSO4 FeSO4 + Cu; sắt kẽm kim loại Cu bám vào thanh Fe tạo thành cặp điện cực Fe-Cu, cùng nhúng trong dd điện li ⟹ Có xẩy ra ăn mòn điện hóa.
– Xét đáp án B:
Không có cặp điện cực rất khác nhau về bản chất ⟹ Không xẩy ra ăn mòn điện hóa.
– Xét đáp án C:
Có cặp điện cực Fe – C nhưng lại bị phủ sơn kín nên không tiếp xúc được môi trường tự nhiên vạn vật thiên nhiên chất điện li, mặt khác không khí khô không phải môi trường tự nhiên vạn vật thiên nhiên chất điện li ⟹ Không xẩy ra ăn mòn điện hóa.
– Xét đáp án D:
Cu chỉ khử được Fe3+ thành Fe2+ chứ không khử được Fe2+ thành Fe nên không còn cặp điện cực rất khác nhau về bản chất ⟹ Không xẩy ra ăn mòn điện hóa.
Đáp án A
Câu 14
Phương pháp:
Ở nhiệt độ cao: H2, CO khử được những oxit sắt kẽm kim loại từ đứng sau Αl (từ Zn trở đi) trong dãy hoạt động và sinh hoạt giải trí hóa học của sắt kẽm kim loại.
Hướng dẫn giải:
H2 khử được những oxit: CuO, Fe2O3
CuO + H2 (xrightarrowt^o) Cu + H2O
Fe2O3 + 3H2 (xrightarrowt^o) 2Fe + 3H2O
Al2O3, MgO không phản ứng ⟹ còn sót lại trong hỗn hợp chất rắn sau phản ứng.
Vậy hỗn hợp chất rắn thu được gồm Cu, Fe, Al2O3, MgO.
Đáp án B
Câu 15
Phương pháp:
*Amin:
– Amin có nguyên tử N gắn trực tiếp với vòng benzen có tính bazơ rất yếu, không làm đổi màu quỳ tím.
– Các amin khác làm quỳ tím chuyển xanh.
*Amino axit:
– Số nhóm NH2 = số nhóm COOH ⟹ Không làm đổi màu quỳ tím
– Số nhóm NH2 > số nhóm COOH ⟹ Làm quỳ tím hóa xanh (VD: Lysin)
– Số nhóm NH2 < số nhóm COOH ⟹ Làm quỳ tím hóa đỏ (VD: Axit glutamic)
Hướng dẫn giải:
– Axit amino axetic hay glyxin trong phân tử có một nhóm NH2 và 1 nhóm COOH
⟹ không làm đổi màu quỳ tím.
– Metylamin (CH3NH2) làm đổi màu quỳ tím thành xanh.
– Axit glutamic trong phân tử có một nhóm NH2 và 2 nhóm COOH
⟹ làm đổi màu quỳ tím thành đỏ.
– Lysin trong phân tử có 2 nhóm NH2 và 1 nhóm COOH
⟹ làm đổi màu quỳ tím thành xanh.
Đáp án A
Câu 16
Phương pháp:
Điều chế sắt kẽm kim loại
Phương pháp thủy luyện:
– Nguyên tắc: Dùng dung dịch thích hợp (HCl, HNO3, nước cường toan, CN-) hòa tan nguyên vật tư tiếp theo đó lấy sắt kẽm kim loại mạnh (không tan trong nước) đẩy sắt kẽm kim loại yếu khỏi dung dịch của nó.
– Phạm vi sử dụng: Thường dùng trong phòng thí nghiệm để điều chế những sắt kẽm kim loại sau Mg (thường là sắt kẽm kim loại yếu).
Phương pháp nhiệt luyện:
– Nguyên tắc: Dùng chất khử CO, C, Al, H2 khử oxit sắt kẽm kim loại ở nhiệt độ cao.
– Phạm vi sử dụng: Thường dùng trong công nghiệp với sắt kẽm kim loại sau Al.
Phương pháp điện phân:
– Nguyên tắc: Dùng dòng điện một chiều để khử những ion sắt kẽm kim loại.
– Phạm vi sử dụng: Điều chế được hầu hết những sắt kẽm kim loại.
Hướng dẫn giải:
– Na, Mg, Αl (hoạt động và sinh hoạt giải trí hóa học mạnh) được điều chế bằng phương pháp điện phân nóng chảy những hợp chất thích hợp tương ứng.
– Cu (hoạt động và sinh hoạt giải trí hóa học yếu) được điều chế bằng phương pháp thủy luyện hoặc phương pháp điện phân dung dịch.
Đáp án C
Câu 17
Phương pháp:
Từ khối lượng hỗn hợp và tỉ lệ mol những chất tính được nCaCO3, nMgCO3.
Bảo toàn nguyên tố C ⟹ nCO2 ⟹ V.
Hướng dẫn giải:
nCaCO3 = nMgCO3 = 16,1 : (100 + 84) = 0,0875 mol.
Bảo toàn nguyên tố C: nCO2 = nCaCO3 + nMgCO3 = 2.0,0875 = 0,175 mol.
⟹ V = 0,175.22,4 = 3,92 lít.
Đáp án C
Câu 18
Phương pháp:
Dựa vào lý thuyết chương Cacbohiđrat.
Hướng dẫn giải:
A là saccarozơ; X, Y là glucozơ và fructozơ; Z là sobitol.
Thủy phân saccarozơ: C12H22O11 (A) + H2O (xrightarrowH^+) C6H12O6 (X) + C6H12O6 (Y)
glucozơ fructozơ
Hiđro hóa glucozơ thu được sobitol; hiđro hóa fructozơ thu được hỗn hợp gồm sobitol và mannitol
⟹ Hiđro hóa glucozơ và fructozơ cùng thu được sobitol (Z).
Đáp án D
Câu 19
Phương pháp:
Các polime hoàn toàn có thể nối với nhau thành:
– Mạch không phân nhánh: amilozơ,
– Mạch phân nhánh: amilopectin, glicogen,
– Mạch mạng không khí: cao su lưu hóa, nhựa bakelit,
Lưu ý: xét sự phân nhánh của toàn mạch polime chứ không phải mạch cacbon của mắt xích.
Hướng dẫn giải:
Các polime có cấu trúc mạch không phân nhánh là: polietilen; poli(vinyl clorua); nilon-6,6; xenlulozơ.
Vậy có 4 polime có cấu trúc mạch không phân nhánh.
Đáp án D
Câu 20
Phương pháp:
Dựa vào lý thuyết chương Cacbohiđrat.
Hướng dẫn giải:
Tinh bột thuộc loại polisaccarit.
Đáp án A
Câu 21
Phương pháp:
Tính độ bất bão hòa k = (frac2C-H+22) ⟹ Đặc điểm cấu trúc của este X.
X được tạo bởi axit cacboxylic và ancol no ⟹ Các đồng phân của X (để ý quan tâm cả đồng phân hình học).
Hướng dẫn giải:
Este X có độ bất bão hòa k = (frac5.2 – 8 + 22) = 2
⟹ X là este đơn chức, mạch hở có một link đôi C=C.
Mặt khác, X được tạo bởi axit cacboxylic và ancol no
⟹ Các đồng phân của X thỏa mãn nhu cầu là:
CH2=CH-CH2-COO-CH3
cis – CH3-CH=CH-COO-CH3
trans – CH3-CH=CH-COO-CH3
CH2=C(CH3)-COO-CH3
CH2=CH-COO-CH2-CH3
Vậy có 5 đồng phân phù phù thích hợp với X.
Đáp án B
Câu 22
Phương pháp:
PTHH: Αl + NaOH + H2O NaAlO2 + 3/2 H2
Từ nH2 ⟹ nAl ⟹ mAl ⟹ mMgO = mX – mAl.
Hướng dẫn giải:
nH2 = 3,36/22,4 = 0,15 mol
Αl + NaOH + H2O NaAlO2 + 3/2 H2
0,1 0,15 (mol)
⟹ mAl = 0,1.27 = 2,7 gam.
⟹ mMgO = mX – mAl = 10,7 – 2,7 = 8 gam.
Đáp án C
Câu 23
Phương pháp:
Dựa vào lý thuyết protein.
Hướng dẫn giải:
Dung dịch protein có phản ứng màu biure với Cu(OH)2 tạo thành phầm có màu tím đặc trưng.
⟹ Khi cho dung dịch anbumin (protein lòng trắng trứng) tác dụng với Cu(OH)2 thu được dung dịch có màu tím.
Đáp án B
Câu 24
Phương pháp:
Các phản ứng xẩy ra:
Ag+ + Cl- AgCl
Ag+ + Fe2+ Fe3+ + Ag
Hướng dẫn giải:
nFeCl2 = 0,05 mol ⟹ nFe2+ = 0,05 mol; nCl- = 0,1 mol.
Ag+ + Cl- AgCl
0,1 0,1 (mol)
Ag+ + Fe2+ Fe3+ + Ag
0,05 0,05 (mol)
Vậy kết tủa thu được sau phản ứng gồm 0,1 mol AgCl và 0,05 mol Ag
⟹ m = 0,1.143,5 + 0,05.108 = 19,75 gam.
Đáp án D
Câu 25
Phương pháp:
Gọi hóa trị của sắt kẽm kim loại M trong phản ứng với H2SO4 loãng là n.
PTHH: 2M + nH2SO4 M2(SO4)n + nH2O
Từ nM = 2nMSO4, chọn cặp nghiệm n, M thích hợp.
Hướng dẫn giải:
Gọi hóa trị của sắt kẽm kim loại M trong phản ứng với H2SO4 loãng là n.
PTHH: 2M + nH2SO4 M2(SO4)n + nH2O
nM = (frac2,52M) (mol)
nMSO4 = (frac6,842M + 96n) (mol)
Theo PTHH: nM = 2nMSO4 ⟹ (frac2,52M = 2.frac6,842M + 96n) ⟹ M = 28n
Chọn n = 2 ⟹ M = 56 (Fe)
Vậy sắt kẽm kim loại M là Fe.
Đáp án C
Câu 26
Phương pháp:
Cắt link -CO-NH- để thu được amino axit (lưu ý chỉ đếm số α-amino axit).
Hướng dẫn giải:
Thủy phân hợp chất trên sẽ thu được những amino axit sau:
H2N-CH(CH3)-COOH (α-amino axit)
NH2-CH2-COOH (α-amino axit)
NH2-CH2-CH2-COOH (không phải α-amino axit)
NH2-CH(C6H5)-COOH (α-amino axit)
Vậy thủy phân hợp chất trên thu được 3 α-amino axit.
Đáp án D
Câu 27
Phương pháp:
Dựa vào lý thuyết hiđrocacbon không no.
Hướng dẫn giải:
Metan (CH4) là hiđrocacbon no ⟹ không tác dụng với Br2.
Buta-1,3-đien (CH3-CH=CH-CH3) có 2 link đôi C=C ⟹ tác dụng với Br2 theo tỉ lệ 1:2.
Etilen (CH2=CH2) có một link đôi C=C ⟹ tác dụng với Br2 theo tỉ lệ 1:1.
Axetilen (CHCH) có một link ba CC ⟹ tác dụng với Br2 theo tỉ lệ 1:2.
Vậy X hoàn toàn có thể là etilen.
Đáp án C
Câu 28
Phương pháp:
Dựa vào lý thuyết polime.
Hướng dẫn giải:
Tơ visco có nguồn gốc từ xenlulozơ.
Đáp án A
Câu 29
Phương pháp:
– Để đơn thuần và giản dị hóa, coi dung dịch Y gồm những amino axit và HCl
⟹ nKOH = nHCl + nCOOH
⟹ nCOOH = nKOH – nHCl
– Công thức chung của hỗn hợp X là: CnH2n+1NO2
CnH2n+1NO2 (X) + O2 (xrightarrowt^o) nCO2 + H2O + ½ N2
Từ PT phản ứng cháy ⟹ nX = (nH2O – nCO2)/0,5
– Đặt nCO2 = x mol; nH2O = y mol
Lập hệ PT tìm x, y nhờ vào:
+) Quan hệ với nX.
+) Khối lượng dung dịch Ba(OH)2 giảm.
– Tính số mol những nguyên tố trong X ⟹ a.
Hướng dẫn giải:
– Để đơn thuần và giản dị hóa, coi dung dịch Y gồm những amino axit và HCl
⟹ nKOH = nHCl + nCOOH
⟹ nCOOH = nKOH – nHCl = 0,38.0,5 – 0,1.1 = 0,09 mol.
Các chất trong X chứa 1 nhóm COOH ⟹ nX = nCOOH = 0,09 mol
– Công thức chung của hỗn hợp X là: CnH2n+1NO2
CnH2n+1NO2 (X) + O2 (xrightarrowt^o) nCO2 + (frac2n + 12)H2O + ½ N2
Từ PT phản ứng cháy ⟹ nX = (nH2O – nCO2)/0,5
Đặt nCO2 = x mol; nH2O = y mol
⟹ (y – x)/0,5 = 0,09 ⟹ y – x = 0,045 (1)
– Cho thành phầm cháy vào trong bình đựng Ba(OH)2 dư:
CO2 + Ba(OH)2 BaCO3 + H2O
x x (mol)
mdd giảm = m – mCO2 – mH2O = 43,74 g.
⟹ 197x – 44x – 18y = 43,74
⟹ 153x – 18y = 43,74 (2)
Từ (1)(2) ⟹ x = 0,33; y = 0,375
⟹ nC = nCO2 = 0,33 mol
nH = 2nH2O = 2.0,375 = 0,75 mol
nO = 2nCOOH = 2.0,09 = 0,18 mol
nN = nX = 2.0,045 = 0,09 mol
⟹ a = 0,33.12 + 0,75 + 0,18.16 + 0,09.14 = 8,85 gam.
Đáp án B
Câu 30
Phương pháp:
Dựa vào lý thuyết phản ứng tráng bạc của glucozơ (tiến trình thí nghiệm rõ ràng xem ở SGK Hóa học 12 cơ bản – trang 23).
Hướng dẫn giải:
Các bước tiến hành thí nghiệm theo thứ tự là:
(4) Cho 1 ml dung dịch AgNO3 1% vào ống nghiệm sạch.
(2) Nhỏ từ từ dung dịch NH3 cho tới lúc kết tủa tan hết.
(1) Thêm 3 – 5 giọt glucozơ vào ống nghiệm.
(3) Đun nóng nhẹ hỗn hợp ở 60 – 70°C trong vài phút.
Đáp án A
Câu 31
Phương pháp:
Giả sử chất béo X có độ bất bão hòa toàn phân tử là k.
+ Khi đốt cháy: (n_X = fracn_CO_2 – n_H_2Ok – 1)
+ Khi tác dụng với Br2 thì: X + (k-3) Br2 Sản phẩm cộng
Hướng dẫn giải:
*Đốt a mol X:
Bảo toàn O nH2O = 6nX + 2nO2 – 2nCO2 = 6a + 2.7,75 – 2.5,5 = 6a + 4,5 (mol)
Giả sử chất béo X có độ bất bão hòa toàn phân tử là k.
Ta có công thức: (n_X = fracn_CO_2 – n_H_2Ok – 1 to a = frac5,5 – left( 6rma + 4,5 right)k – 1)
ak + 5a = 1 (1)
*a mol X + Br2 thì:
X + (k – 3)Br2 Sản phẩm cộng
nBr2 = (k – 3).nX 0,2 = (k – 3).a
ak – 3a = 0,2 (2)
Như vậy ta có hệ pt: (left{ beginarray*20lak + 5rma = 1\ak – 3rma = 0,2endarray right. to left{ beginarray*20lak = 0,5\a = 0,1endarray right. to left{ beginarray*20lk = 5\a = 1endarray right.)
BTKL phản ứng cháy mX = mCO2 + mH2O – mO2 = 85,8 gam
BTKL phản ứng thủy phân mmuối = mX + mNaOH – mC3H5(OH)3 = 85,8 + 0,3.40 – 0,1.92 = 88,6 gam.
Đáp án D
Câu 32
Phương pháp:
Rót từ từ H+ vào dung dịch hỗn hợp HCO3- + CO32- xẩy ra 2 phản ứng theo thứ tự lần lượt:
H+ + CO32 HCO3-
HCO3- + H+ CO2 + H2O
Hướng dẫn giải:
Rót từ từ H+ vào dung dịch hỗn hợp HCO3- + CO32- xẩy ra 2 phản ứng theo thứ tự lần lượt:
H+ + CO32 HCO3- (1)
H+ + HCO3- CO2 + H2O (2)
– Khi nH+ = 2a mol, đã có khí CO2 thoát ra
⟹ (1) kết thúc, (2) đang xẩy ra.
⟹ nCO2 = nH+(2) = nH+ – nH+(1) = nH+ – nCO32- = 2a – a = a (mol).
⟹ a = 0,25x hay x = 4a.
– Để phản ứng hết với HCO3- và CO32-, lượng HCl cần dùng bằng:
nHCl = nHCO3- + 2nCO32- = 1,25a + 2a = 3,25a (mol).
– Khi nHCl = x = 4a mol, dung dịch gồm:
(left{ beginarray*20lKCl:3,25a^mol\HCl_du:4a – 3,25a = 0,75a^molleft( BTNT.Cl right)endarray right.)
⟹ 74,5 . 3,25a + 36,5 . 0,75a = 97,02
⟹ a = 0,36 mol.
Đáp án D
Câu 33
Phương pháp:
MTB amin = 35,67 ⟹ 2 amin là CH3NH2 và C2H5NH2.
Kết hợp:
– Công thức phân tử của X và Y
– Công thức của axit glutamic: HOOC-CH2-CH2-CH(NH2)-COOH
– Công thức 2 amin
– Hỗn hợp G gồm 3 muối trong số đó có 2 muối có cùng số C
⟹ CTCT của X và Y
⟹ Thành phần những muối ⟹ m.
Hướng dẫn giải:
MTB amin = 107/6 . 2 = 35,67 ⟹ 2 amin là CH3NH2 và C2H5NH2.
Đặt nCH3NH2 = a mol; nC2H5NH2 = b mol
⟹ (left{ beginarray*20la + b = 0,33\31a + 45b = 0,33.frac1076.2 = 11,77endarray right.)
⟹ a = 0,22; b = 0,11 (mol)
Kết hợp những dữ kiện:
– Công thức phân tử của X và Y
– Công thức của axit glutamic: HOOC-CH2-CH2-CH(NH2)-COOH
– Công thức 2 amin
– Hỗn hợp G gồm 3 muối trong số đó có 2 muối có cùng số C
⟹ Công thức của X và Y lần lượt là:
X: (COONH3C2H5)2
Y: CH3NH3OOC-CH2-CH2-CH(NH3OOCCH3)-COOCH3NH3
⟹ nX = b/2 = 0,055 mol; nY = a/2 = 0,11 mol
– Khi hỗn hợp E + KOH:
(COONH3C2H5)2 + 2KOH (COOK)2 + 2C2H5NH2 + 2H2O
CH3NH3OOC-CH2-CH2-CH(NH3OOCCH3)-COOCH3NH3 + 3KOH KOOC-CH2-CH2-CH(NH2)-COOK + CH3COOK + 2CH3NH2 + 3H2O
Muối thu được gồm:
(left{ beginarray*20l(COOK)_2:0,055^mol\CH_3COOK:0,11^mol\KOOCCH_2CH_2CH(NH_2)COOK:0,11^molendarray right.)
⟹ m = 44,44 gam.
Đáp án D
Câu 34
Phương pháp:
Chia đồ thị thành những đoạn như hình.
Ta thấy đoạn (2) độ dốc thấp hơn so với đoạn (1)
Suy ra:
– Giai đoạn 1: Khí Cl2 thoát ra từ anot.
– Giai đoạn 2: Khí O2 thoát ra từ anot.
– Giai đoạn 3: Khí O2 thoát ra từ anot, khí H2 thoát ra từ catot.
Hướng dẫn giải:
– Chia đồ thị thành những đoạn như ở phần Phương pháp.
Ta thấy đoạn (2) độ dốc thấp hơn so với đoạn (1)
Suy ra:
+ Giai đoạn 1: Khí Cl2 thoát ra từ anot (ở catot Cu2+ bị điện phân; ở anot Cl- bị điện phân)
+ Giai đoạn 2: Khí O2 thoát ra từ anot (ở catot Cu2+ bị điện phân; ở anot hết Cl-, nước bị điện phân)
+ Giai đoạn 3: Khí O2 thoát ra từ anot, khí H2 thoát ra từ catot (ở catot hết Cu2+, nước bị điện phân; ở anot nước bị điện phân).
– Khi kết thúc quy trình (1): t = a (s); ứng với việc trao đổi b (mol) electron
Ở anot: 2Cl- – 2e Cl2
b 0,5b (mol)
– Khi kết thúc quy trình (2): t = 3a (s); ứng với việc trao đổi 3b (mol) electron
Ở anot: 2Cl- – 2e Cl2
b 0,5b (mol)
H2O – 2e 2H+ + ½ O2
2b 0,5b (mol)
– Khi t = 4a (s), tổng số mol khí thu được là 0,35 mol; ứng với việc trao đổi 4b (mol) electron
Ở anot: 2Cl- – 2e Cl2
b 0,5b (mol)
H2O – 2e 2H+ + ½ O2
3b 0,75b (mol)
Ở catot: Cu2+ + 2e Cu
3b 1,5b (mol)
2H2O + 2e 2OH- + H2
b 0,5b (mol)
⟹ 0,5b + 0,75b + 0,5b = 0,35 ⟹ b = 0,2 mol
⟹ nCu(NO3)2 = 1,5.0,2 = 0,3 mol
nNaCl = b = 0,2 mol
– Khi t = 2a (s); ứng với việc trao đổi 2b = 0,4 mol electron
Ở anot: 2Cl- – 2e Cl2
0,2 0,1 (mol)
H2O – 2e 2H+ + ½ O2
0,2 0,05 (mol)
Ở catot: Cu2+ + 2e Cu
0,4 0,2 (mol)
⟹ Dung dịch khi đó gồm:
(left{ beginarray*20lCu^2 + :0,3 – 0,2 = 0,1^mol\Na^ + :0,2^mol\H^ + :0,2^mol\NO_3^ – :0,6^molendarray right.) ⟹ (left{ beginarray*20lCu(NO_3)_2:0,1^mol\NaNO_3:0,2^mol\HNO_3:0,2^molendarray right.)
⟹ Tổng số mol những chất tan là 0,1 + 0,2 + 0,2 = 0,5 mol.
Đáp án B
Câu 35
Phương pháp:
– Hỗn hợp khí Z gồm CO2: x (mol) và CO dư: y (mol)
Lập hệ PT tìm x, y nhờ vào số mol và khối lượng hỗn hợp Z.
⟹ nO(bị CO lấy đi) = nCO2
⟹ mY = mX – mO(bị CO lấy đi); nO(Y) = nO/X – nO(bị CO lấy đi)
– Ta thấy H+ tham gia vào những bán phản ứng sau:
4H+ + NO3- + 3e NO + 2H2O
2H+ + O2- H2O
⟹ nHNO3 = nH+ = 4nNO + 2nO/Y
⟹ nH2O = nHNO3/2
Bảo toàn khối lượng: mY + mHNO3 = mmuối + mNO + mH2O
⟹ m.
Hướng dẫn giải:
nCO(bđ) = 0,4 mol; nNO = 0,32 mol
– Hỗn hợp khí Z gồm CO2: x (mol) và CO dư: y (mol)
⟹ (left{ beginarray*20lx + y = n_CO = 0,4\44x + 28y = m_Z = 0,4.19.2 = 15,2endarray right.)
⟹ x = 0,25; y = 0,15 (mol)
⟹ nO(bị CO lấy đi) = nCO2 = 0,25 (mol)
⟹ mY = mX – mO(bị CO lấy đi) = m – 0,25.16 = m – 4 (g)
⟹ nO(Y) = nO(X) – nO(bị CO lấy đi) = (frac0,2593m16 – 0,25)(mol)
– Ta thấy H+ tham gia vào những bán phản ứng sau:
4H+ + NO3- + 3e NO + 2H2O
2H+ + O2- H2O
⟹ nHNO3 = nH+ = 4nNO + 2nO(Y) = 4.0,32 + 2((frac0,2593m16 – 0,25)) = (1,28 + frac0,2593m8 – 0,5)
⟹ nH2O = nHNO3/2 = (0,64 + frac0,2593m16 – 0,25)
Bảo toàn khối lượng: mY + mHNO3 = mmuối + mNO + mH2O
⟹ (m – 4 + 63(1,28 + frac0,2593m8 – 0,5) = 3,456m + 30.0,32 + 18(0,64 + frac0,2593m16 – 0,25))
⟹ m 38,43 gam.
Đáp án A
Câu 36
Phương pháp:
Tính số mol CO2, H2O; số mol X, Y, Z trong hỗn hợp E.
⟹ Số nguyên tử H trong X, Y, Z = 2nH2O/nX
⟹ Công thức của X.
Gọi số nguyên tử cacbon trong Y là a; số nguyên tử cacbon trong Z là b; biện luận theo số mol CO2 để tìm a, b.
⟹ Công thức của Y, Z.
⟹ nAg pứ ⟹ mAg.
Hướng dẫn giải:
– Khi đốt cháy hỗn hợp E:
nCO2 = 24,64/22,4 = 1,1 mol
nH2O = 21,6/18 = 1,2 mol
⟹ (H = fracn_Hn_hh = frac2n_H_2On_hh = frac2.1,20,6 = 4)
⟹ Ancol X phải là CH3OH
Tỉ lệ mol X, Y, Z là 3 : 1 : 2 ⟹ nX = 0,3 mol; nY = 0,1 mol; nZ = 0,2 mol.
– Gọi số nguyên tử cacbon trong Y là a; số nguyên tử cacbon trong Z là b (a, b 2)
⟹ 0,3 + 0,1a + 0,2b = 1,1
⟹ a + 2b = 8
⟹ a = 2, b = 3 thỏa mãn nhu cầu ⟹ Y là HCOOCH3, Z là OHC-CH2-CHO
– Y (HCOOCH3) phản ứng với Ag theo tỉ lệ 1 : 2, Z (HOC-CH2-CHO) phản ứng với Ag theo tỉ lệ 1 : 4
⟹ nAg = 2nY + 4nZ = 2.0,1 + 4.0,2 = 1 mol
⟹ mAg = 108 gam.
Đáp án C
Câu 37
– (a) đúng, thủy phân tripanmitin thu được glixerol, thủy phân etyl axetat thu được ancol etylic.
VD với MT kiềm:
(C15H31COO)3C3H5 + 3NaOH (xrightarrow[]t^o) 3C15H31COONa + C3H5(OH)3
CH3COOC2H5 + NaOH (xrightarrow[]t^o) CH3COONa + C2H5OH
– (b) đúng, mỡ động vật hoang dã và dầu thực vật đều chứa nhiều chất béo.
– (c) sai, hiđro hóa hoàn toàn triolein thu được tristearin.
(C17H33COO)3C3H5 (triolein) + 3H2 (xrightarrow[t^o]Ni) (C17H35COO)3C3H5 (tristearin).
– (d) đúng, thủy phân vinyl fomat thu được hai thành phầm đều phải có phản ứng tráng bạc:
HCOOCH=CH2 (xrightarrow[H_2SO_4dac,t^o]H_2O) HCOOH + CH3CHO
HCOOCH=CH2 (xrightarrow[t^o]NaOH) HCOONa + CH3CHO
– (e) đúng: ứng với công thức đơn thuần và giản dị nhất là CH2O có 3 chất hữu cơ đơn chức, mạch hở:
HCHO (anđehit đơn chức)
CH3COOH (axit đơn chức)
HCOOCH3 (este đơn chức)
Vậy có 4 phát biểu đúng (a, b, d, e).
Đáp án B
Câu 38
Phương pháp:
– Khi đốt cháy hỗn hợp T gồm 2 muối:
nNa(T) = 2nNa2CO3
Bảo toàn nguyên tố O: 2nCOONa + 2nO2 = 2nCO2 + 3nNa2CO3 + nH2O ⟹ nCO2
Đánh giá nNa(T) và nC(T) để tìm ra công thức 2 muối.
– Khi thủy phân hỗn hợp A:
nNaOH = nNa(T) ⟹ mNaOH
Bảo toàn khối lượng ⟹ mA
– Khi đốt cháy hỗn hợp A:
Đặt nCO2 = x mol; nH2O = y mol
Lập hệ PT tìm x, y nhờ vào chênh lệch số mol CO2 và số mol H2O; khối lượng hỗn hợp A (quy về 3 nguyên tố C, H, O).
– Dùng liên tục những định luật bảo toàn để tìm số mol những nguyên tố C, H, O trong hỗn hợp ancol, tiếp theo đó nhìn nhận và tìm ra công thức 2 ancol
– Ghép những muối và những ancol một cách thích hợp để tìm ra công thức những este ban đầu.
Hướng dẫn giải:
– Khi đốt cháy hỗn hợp T gồm 2 muối:
nNa(T) = 2nNa2CO3 = 2.0,35 = 0,7 mol
Bảo toàn nguyên tố O: 2nCOONa + 2nO2 = 2nCO2 + 3nNa2CO3 + nH2O
⟹ nCO2 = (2.0,7 + 2.0,275 – 3.0,35 – 0,2) : 2 = 0,35 mol
Bảo toàn nguyên tố C: nC(T) = nCO2 + nNa2CO3 = 0,35 + 0,35 = 0,7 mol
⟹ nNa(T) = nC(T) ⟹ Các chất trong T có số nguyên tử C bằng số nguyên tử Na
⟹ T gồm 2 muối HCOONa và (COONa)2
nHCOONa = 2nH2O = 2.0,2 = 0,4 mol
n(COONa)2 = (0,7 – 0,4) : 2 = 0,15 mol
⟹ mT = 0,4.68 + 0,15.134 = 47,3 gam.
– Khi thủy phân hỗn hợp A:
nNaOH = nNa(T) = 0,7 mol ⟹ mNaOH = 40.0,7 = 28 gam.
Bảo toàn khối lượng: mA = mancol + mT – mNaOH = 22,2 + 47,3 – 28 = 41,5 gam.
– Khi đốt cháy hỗn hợp A:
Đặt nCO2 = x mol; nH2O = y mol
⟹ x – y = 0,25 mol (1)
nO(A) = 2nCOO = 2nNa(T) = 2.0,7 = 1,4 mol
Trong A gồm: x mol C; 2y mol H; 1,4 mol O
⟹ 12x + 2y + 1,4.16 = 41,5
⟹ 12x + 2y = 19,1 (2)
Từ (1)(2) ⟹ x = 1,4; y = 1,15
– Bảo toàn nguyên tố C:
nC(ancol) = nC(A) – nC(T) = 1,4 – 0,7 = 0,7 mol
nO(ancol) = nNaOH = 0,7 mol
nH(ancol) = nH(A) – nH(T) = 2.1,15 + 0,7 – 0,4 = 2,6 mol
⟹ nancol = nH2O – nCO2 = 2,6/2 – 0,7 = 0,6 mol (do số nguyên tử O trong ancol bằng số nguyên tử C nên 2 ancol đều là ancol no).
⟹ Số C TB = 0,7/0,6 = 1,17
Mặt khác, số nguyên tử O trong ancol bằng số nguyên tử C
⟹ Hai ancol đó là CH3OH: a mol và C2H4(OH)2: b mol
⟹ (left{ beginarray*20lx + y = 0,6\x + 2y = 0,7endarray right.). ⟹ x = 0,5; y = 0,1
– Ghép 2 muối ở hỗn hợp T và 2 ancol ta được:
(left{ beginarray*20lHCOOCH_3:0,2^mol\(HCOO)_2C_2H_4:0,1^mol\(COOCH_3)_2:0,15^molendarray right.)
%mHCOOCH3 = 0,2.60/41,5 . 100% = 28,92%
%m(HCOO)2C2H4 = 0,1.118/41,5 . 100% = 28,43%
%m(COOCH3)2 = 100% – 28,92% – 28,43% = 42,65%
Mà Z chiếm % khối lượng lớn số 1 ⟹ %mZ = 42,65%.
Đáp án B
Câu 39
Phương pháp:
Phản ứng oxi hóa – khử là phản ứng hóa học trong số đó có sự thay đổi số oxi hóa của những nguyên tố.
Hướng dẫn giải:
(a) Cu + Fe2(SO4)3 CuSO4 + 2FeSO4
(b) CO2 + Ca(OH)2 CaCO3 + H2O
(c) 4NO2 + O2 + 2H2O 4HNO3
(d) 3Fe2+ + 4H+ + NO3- 3Fe3+ + NO + 2H2O
(e) 2FeO + 4H2SO4 đặc, nóng Fe2(SO4)3 + SO2 + 4H2O
(f) BaO + H2O Ba(OH)2
⟹ Có 4 thí nghiệm xẩy ra phản ứng oxi hóa – khử: a, c, d, e.
Đáp án B
Câu 40
Phương pháp:
Dựa vào lý thuyết hữu cơ tổng hợp chương 1-2-3-4.
Hướng dẫn giải:
(a) đúng, dầu mỡ sau khi sử dụng, hoàn toàn có thể tái chế thành nhiên liệu.
(b) đúng, muối mononatri của axit glutamic được sử dụng làm bột ngọt (mì chính).
(c) đúng, amilopectin, tơ tằm, lông cừu là polime vạn vật thiên nhiên.
(d) đúng, chất độn amiăng làm tăng tính chịu nhiệt của chất dẻo.
(e) đúng, khi cho giấm ăn (hoặc chanh) vào sữa bò hoặc sữa đậu nành thì thấy có kết tủa xuất hiện (sự đông tụ protein).
(f) đúng, thành phần chính của khí biogas là metan.
Vậy cả 6 nhận định đều đúng.
Đáp án D
Reply
5
0
Chia sẻ
Chia Sẻ Link Download Đề bài – đề số 5 – đề kiểm tra giữa kì ii – hóa học 9 có lời giải miễn phí
Bạn vừa tìm hiểu thêm nội dung bài viết Với Một số hướng dẫn một cách rõ ràng hơn về Video Đề bài – đề số 5 – đề kiểm tra giữa kì ii – hóa học 9 có lời giải tiên tiến và phát triển nhất và ShareLink Download Đề bài – đề số 5 – đề kiểm tra giữa kì ii – hóa học 9 có lời giải miễn phí.

Giải đáp vướng mắc về Đề bài – đề số 5 – đề kiểm tra giữa kì ii – hóa học 9 có lời giải
Nếu sau khi đọc nội dung bài viết Đề bài – đề số 5 – đề kiểm tra giữa kì ii – hóa học 9 có lời giải vẫn chưa hiểu thì hoàn toàn có thể lại Comments ở cuối bài để Admin lý giải và hướng dẫn lại nha
#Đề #bài #đề #số #đề #kiểm #tra #giữa #kì #hóa #học #có #lời #giải