Mẹo Hướng dẫn Bài tập phản ứng trao đổi ion trong dung dịch những chất điện li 2022
Bạn đang tìm kiếm từ khóa Bài tập phản ứng trao đổi ion trong dung dịch những chất điện li được Update vào lúc : 2022-04-20 16:10:06 . Với phương châm chia sẻ Thủ Thuật về trong nội dung bài viết một cách Chi Tiết Mới Nhất. Nếu sau khi tìm hiểu thêm nội dung bài viết vẫn ko hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Tác giả lý giải và hướng dẫn lại nha.

Nội dung chính
- I. ĐIỀU KIỆN XẢY RA PHẢN ỨNG TRAOĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI
- II. KẾT LUẬN
- II. Kết luận
- B. Bài tập:
I. ĐIỀU KIỆN XẢY RA PHẢN ỨNG TRAOĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI
1.Phản ứng tạo thành chất kết tủa
– Thí nghiệm:

– Giải thích: Na2SO4 và BaCl2 đều dễ tan và phân li mạnh trong nước:
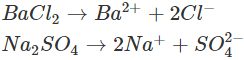
Trong số bốn ion được phân li ra chỉ có những ion 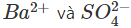 phối hợp được với nhau tạo thành chất kết tủa là BaSO4 (hình trên), nên thực ra phản ứng trong dung dịch là:
phối hợp được với nhau tạo thành chất kết tủa là BaSO4 (hình trên), nên thực ra phản ứng trong dung dịch là:
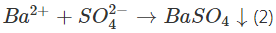
Phương trình (2) được gọi là phương trình ion rút gọn của phản ứng (1).
Phương trình ion rút gọn cho biết thêm thêm bản chất của phản ứng trong dung dịch những chất điện li.
2.Phản ứng tạo thành chất điện li yếu
a) Phản ứng tạo thành nước
– Thí nghiệm:

Phản ứng như sau:
HCl + NaOH → NaCl + H2O
– Giải thích: NaOH và HCl đều dễ tan và phân li mạnh trong nước:
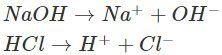
Các ion OH−trong dung dịch làm cho phenolphtalein chuyển sang màu hồng. Khi cho dung dịch HCl vào, những ion H+ của HCl sẽ phản ứng với những ion OH− của NaOH tạo thành chất điện li rất yếu là H2O. Phương trình ion rút gọn:
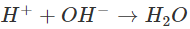
Khi màu của dung dịch trong cốc mất, đó là lúc những ion H+ của HCl đã phản ứng hết với những ion OH− của NaOH.
Phản ứng giữa dung dịch axit và hiđroxit có tính bazơ rất dễ dàng xẩy ra vì tạo thành chất điện li rất yếu là H2O. Mg(OH)2 ít tan trong nước, nhưng thuận tiện và đơn thuần và giản dị tan trong dung dịch axit mạnh:
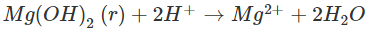
b)Phản ứng tạo thành axit yếu
– Thí nghiệm: Nhỏ dung dịch HCl vào ống nghiệm đựng dung dịch CH3COONa , axit yếu CH3COOH sẽ tạo thành:
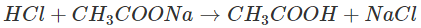
– Giải thích: HCl và CH3COONa là những chất dễ tan và phân li mạnh:
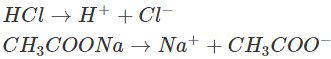
Trong dung dịch, những ion H+ sẽ kết phù thích hợp với những ion CH3COO- tạo thành chất điện li yếu là CH3COOH (mùi giấm). Phương trình ion rút gọn:
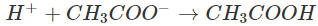
3. Phản ứng tạo thành chất khí
Thí nghiệm:

Phương trình ion rút gọn: 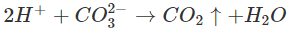
Phản ứng giữa muối cacbonat và dung dịch axit rất dễ dàng xẩy ra vì vừa tạo thành chất điện li rất yếu là H2O, vừa tạo ra chất khí CO2 tách khỏi môi trường tự nhiên vạn vật thiên nhiên phản ứng. Chẳng hạn, những muối cacbonat ít tan trong nước nhưng tan thuận tiện và đơn thuần và giản dị trong những dung dịch axit. Đá vôi (CaCO3) tan rất dễ dàng trong dung dịch HCl:
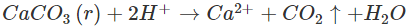
II. KẾT LUẬN
1.Phản ứng xẩy ra trong dung dịch những chất điện li là phản ứng Một trong những ion.
2.Phản ứng trao đổi ion trong dung dịch những chất điện li chỉ xẩy ra khi những ion phối hợp được với nhau tạo thành tối thiểu một trong những chất sau:
_ chất kết tủa.
_ chất điện li yếu.
_ chất khí.
Xem thêm Giải Hóa 11: Bài 4. Phản ứng trao đổi ion trong dung dịch những chất điện li
1. Phản ứng tạo thành chất kết tủa:
– Phương trình dạng phân tử:
– Phương trình ion khá đầy đủ:
– Phương trình ion rút gọn:
→ Phương trình ion rút gọn cho biết thêm thêm bản chất của quy trình là phản ứng giữa ion Ba2+ và SO42- tạo kết tủa BaSO4.
* Lưu ý: Khi viết phương trình ion rút gọn, những chất khí, rắn, chất điện li yếu được không thay đổi trong phương trình phản ứng
2. Phản ứng tạo thành chất điện li yếu
a. Phản ứng tạo thành nước:
Xét phương trình:
Pt ion:
Phương trình ion rút gọn:
→Phản ứng giữa dung dịch axít và bazơ rất dễ dàng xẩy ra vì tạo thành chất điện li rất yếu là H2O
b. Phản ứng tạo thành axít yếu:
Xét phương trình:
– Phương trình ion khá đầy đủ:
– Phương trình ion thu gọn:
3. Phản ứng tạo thành chất khí:
Xét phương trình:
– Phương trình ion khá đầy đủ:
– Phương trình ion thu gọn:
II. Kết luận
– Phản ứng xẩy ra trong dung dịch những chất điện li là phản ứng Một trong những ion
– Để phản ứng trao đổi ion trong dung dịch những chất điện li xẩy ra khi những ion phối hợp được với nhau tạo thành tối thiểu một trong những chất sau:
+ Chất kết tủa
+ Chất điện li yếu
+ Chất khí
– Có thể dựa vào bảng tính tan để xác định nhanh các phản ứng xảy ra giữa các ion trong dung dịch:

B. Bài tập:
1. Dạng 1: Liên hệ phương trình phân tử – phương trình ion – phương trình ion rút gọn:
VD1: Viết phương trình dạng phân tử và ion rút gọn của những phản ứng xẩy ra trong dung dịch Một trong những cặp chất sau:
a. Fe2(SO4)3 + NaOH
b. Ca(HCO3)2 + HCl
c. Cu(OH)2 rắn + H2SO4
Lời giải:
a.
b.
c.
VD2: Phương trình ion: là phương trình ion thu gọn của phản ứng hoá học :
A.
B.
C.
d.
Lời giải:
PT ion:
PT ion rút gọn:
Đáp án A.
2. Dạng 2: Điều kiện của phản ứng trao đổi ion:
VD1: Ion OH– không thể phản ứng với toàn bộ những ion trong dãy
A. H+ , NH4+ , HCO3– B. Fe2+ , HSO4– , HSO3–
C. HCO3– , Ba2+ , Fe3+ D. Mg2+ , Cu2+ , H2PO4–
Lời giải:
3. Dạng 3: Bài tập tính toán theo phương trình ion rút gọn
VD1: Trong y học,dược phẩm Nabica (NaHCO3) là chất dùng để trung hòa bớt lượng dư axit HCl trong dạ dày.
a. Viết PTHH dưới dạng phân tử và ion rút gọn của phản ứng.
b. Nồng độ axit HCl trong dạ dày 0,035M, tính thể tích dung dịch HCl được trung hòa và thể tích CO2 (đktc) sinh ra khi uống 0,336g NaHCO3.
Lời giải:
a.
b.
VD2: Hòa tan 6,33 gam NaCl và KCl trong nước, xử lý dung dịch thu được bằng một lượng dư dung dịch AgNO3 thu được 14,35 gam kết tủa. Tính thành phần Phần Trăm của mỗi chất trong hỗn hợp.
Lời giải:
mà
Vậy %NaCl = 64,69%; %KCl = 35,31%
Chia Sẻ Link Tải Bài tập phản ứng trao đổi ion trong dung dịch những chất điện li miễn phí
Bạn vừa Read nội dung bài viết Với Một số hướng dẫn một cách rõ ràng hơn về Video Bài tập phản ứng trao đổi ion trong dung dịch những chất điện li tiên tiến và phát triển nhất và Share Link Down Bài tập phản ứng trao đổi ion trong dung dịch những chất điện li Free.

Giải đáp vướng mắc về Bài tập phản ứng trao đổi ion trong dung dịch những chất điện li
Nếu sau khi đọc nội dung bài viết Bài tập phản ứng trao đổi ion trong dung dịch những chất điện li vẫn chưa hiểu thì hoàn toàn có thể lại phản hồi ở cuối bài để Mình lý giải và hướng dẫn lại nha
#Bài #tập #phản #ứng #trao #đổi #ion #trong #dung #dịch #những #chất #điện