Kinh Nghiệm về Phương trình ion rút gọn của CaSo3 + HCL Chi Tiết
You đang tìm kiếm từ khóa Phương trình ion rút gọn của CaSo3 + HCL được Cập Nhật vào lúc : 2022-04-24 19:10:13 . Với phương châm chia sẻ Thủ Thuật Hướng dẫn trong nội dung bài viết một cách Chi Tiết Mới Nhất. Nếu sau khi đọc tài liệu vẫn ko hiểu thì hoàn toàn có thể lại Comments ở cuối bài để Tác giả lý giải và hướng dẫn lại nha.
Chất này được sử dụng hầu hết trong công nghiệp xây dựng như đá xây dựng, cẩm thạch hoặc là thành phần cầu thành của xi-măng hoặc từ nó sản xuất ra vôi. Trong đá vôi thường có cả cacbonat magiê. Cacbonat canxi được sử dụng rộng tự do trong vai trò của chất kéo duỗi trong nhiều chủng loại sơn, rõ ràng là trong sơn nhũ tương xỉn trong số đó thông thường khoảng chừng 30% khối lượng sơn là đá phấn hay đá hoa. Cacbonat canxi cũng khá được sử dụng rộng tự do làm chất độn trong chất dẻo. Một vài ví dụ điển hình gồm có tầm khoảng chừng 15 – 20% đá phấn trong ống dẫn nước bằng PVC không hóa dẻo (uPVC), 5 đến 15% đá phấn hay đá hoa tráng stearat trong khung hiên chạy cửa số bằng uPVC. Cacbonat canxi mịn là thành phần chủ chốt trong lớp màng vi xốp sử dụng trong tã giấy cho trẻ con và một số trong những màng xây dựng do những lỗ hổng kết nhân xung quanh những hạt cacbonat canxi trong quy trình sản xuất màng bằng phương pháp kéo giãn lưỡng trục. Cacbonat canxi cũng khá được sử dụng rộng tự do trong một loạt những việc làm và những chất kết dính tự chế, chất bịt kín và những chất độn trang trí. Các keo dán ngói bằng gốm thường chứa khoảng chừng 70-80% đá vôi. Các chất độn chống nứt trang trí chứa hàm lượng tương tự của đá hoa hay đolomit. Nó cũng khá được trộn lẫn với mát tít để lắp những hiên chạy cửa số kính biến màu, cũng như chất cản màu để ngăn không cho thủy tinh bị dính vào những ngăn trong lò khi nung những đồ tráng men hay vẽ bằng thuốc màu ở nhiệt độ cao. Cacbonat canxi cũng khá được sử dụng rộng tự do trong y tế với vai trò là thuốc tương hỗ update khẩu phần canxi giá rẻ, chất khử chua và/hoặc chất gắn phốtphat. Nó cũng khá được sử dụng trong công nghiệp dược phẩm làm chất nền cho thuốc viên làm từ loại dược phẩm khác. Cacbonat canxi được nghe biết là “chất làm trắng” trong việc tráng men đồ gốm sứ nơi nó được sử dụng làm thành phần chung cho nhiều loại men dưới dạng bột trắng. Khi lớp men có chứa chất này được nung trong lò, chất vôi trắng là vật tư trợ chảy trong men. Nó cũng thường được gọi là đá phấn vì nó là thành phần chính của phấn viết bảng. Phấn viết ngày này hoàn toàn có thể hoặc làm từ cacbonat canxi hoặc là thạch cao, sulfat canxi ngậm nước CaSO4·2H2O. Ở Bắc Mỹ, cacbonat canxi đã khởi đầu thay thế cao lanh trong việc sản xuất giấy bóng. châu Âu đã thực thi việc sản xuất giấy kiềm hay sản xuất giấy không axit trong nhiều thập kỷ. Cacbonat có sẵn dưới những dạng: cacbonat canxi ngầm hay cacbonat canxi kết tủa. Loại kết tủa này rất mịn và có kích cỡ hạt khống chế được, có kích thước ở tại mức đường kính khoảng chừng 2 micron, hữu dụng trong việc làm lớp tráng ngoài của giấy. Là một phụ gia thực phẩm, nó được sử dụng trong một số trong những thành phầm như đậu phụ , là nguồn tương hỗ update khẩu phần canxi. Hay dùng thạch cao để muối chua mướp đắng. Ngày nay, cacbonat canxi được sử dụng để trung hòa tình trạng chua ở trong đất và nước (như ở ruộng phèn).
Nội dung chính
- 1. Ứng dụng của hidro clorua
- 2. Ứng dụng của axit clohidric
- Độc tính
- 1. Tài nguyên nước và quy trình nước toàn thế giới
- 2. Vai trò của nước
- 3. Sự thật thú vị
- CO2 (Cacbon dioxit )
- 1. Ngành công nghiệp thực phẩm
- 2. Khí trơ
- 3. Sản xuất dược phẩm và một số trong những ngành công nghiệp chế biến khác
- 4. Vai trò sinh học
- 5. Băng khô
- CaCl2 (Canxi diclorua )

Hydro clorua là một chất khí không màu đến hơi vàng, có tính ăn mòn, không cháy, nặng hơn không khí và có mùi rất khó chịu ở nhiệt độ và áp suất thường. Dung dịch của khí HCl trong nước được gọi là axit clohidric. Axit clohidric thường được bán trên thị trường dưới dạng dung dịch chứa 28 – 35 % thường được gọi là axit clohydric đậm đặc. Hydro clorua có nhiều hiệu suất cao, gồm có làm sạch, tẩy, mạ điện sắt kẽm kim loại, thuộc da, tinh chế và sản xuất nhiều loại thành phầm. Axit clohidric có thật nhiều hiệu suất cao như sử dụng trong sản xuất clorua, phân bón và thuốc nhuộm, trong mạ điện và trong những ngành công nghiệp nhiếp ảnh, dệt may và cao su.
1. Ứng dụng của hidro clorua
Hydro clorua hoàn toàn có thể được giải phóng từ núi lửa và nó hoàn toàn có thể được hình thành trong quy trình đốt cháy nhiều loại nhựa. Sau đấy là một số trong những ứng dụng nổi trội của hidro clorua:
– Sản xuất axit clohidric
– Hidroclorinat hóa cao su
– Sản xuất những clorua vinyl và alkyl
– Là chất trung gian hóa học trong những sản xuất hóa chất khác
– Làm chất trợ chảy babit
– Xử lý bông
– Trong công nghiệp bán dẫn (loại tinh khiết) như khắc những tinh thể bán dẫn; chuyển silic thành SiHCl3 để làm tinh khiết sillic.
2. Ứng dụng của axit clohidric
Axit clohidric là một axit mạnh được sử dụng trong nhiều ngành công nghiệp.
a. Tẩy gỉ thép
Một trong những ứng dụng quan trọng của axit clohidric là dùng để vô hiệu gỉ trên thép, đó là những oxit sắt, trước lúc thép được đưa vào sử dụng với những mục tiêu khác ví như cán, mạ điện và những kỹ thuật khác. HCl dùng trong kỹ thuật có nồng độ 18% là phổ cập, được sử dụng làm chất tẩy gỉ của nhiều chủng loại thép carbon.

Công nghiệp tẩy thép đã tiếp tục tăng trưởng những công nghệ tiên tiến và phát triển “tái chế axit clohidric” như công nghệ tiên tiến và phát triển lò phun hoặc công nghệ tiên tiến và phát triển tái sinh HCl tầng sôi, quy trình này được cho phép tịch thu HCl từ chất lỏng đã tẩy rửa.
b. Sản xuất những hợp chất hữu cơ
Trong tổng hợp hữu cơ, axit clohidric được sử dụng để tổng hợp vinyl clorua và dicloroetan để sản xuất PVC. Tuy nhiên, quy trình này những doanh nghiệp sẽ sử dụng axit do họ sản xuất chứ không phải axit từ thị trường tự do.
Một số chất hữu cơ khác được sản xuất từ axit HCl đó là bisphenol A , polycacbonat, than hoạt tính, axit ascobic cũng như một số trong những thành phầm của ngành Dược.
c. Sản xuất những hợp chất vô cơ
Các hóa chất vô cơ được tổng hợp từ axit clohidric đó là sắt (III) clorua và polyaluminium clorua (PAC). Hai hóa chất này được sử dụng làm chất keo tục và chất đông tụ để làm lắng những thành phần trong quy trình xử lý nước thải, sản xuất nước uống và sản xuất giấy.
Ngoài ra, những hợp chất vô cơ khác được sản xuất dùng HCl như muối canxi clorua, niken (II) clorua dùng cho việc mạ điện và kẽm clorua cho công nghiệp mạ và sản xuất pin.
d. Kiểm soát và trung hòa pH
Trong công nghiệp yêu cầu độ tinh khiết (thực phẩm, dược phẩm, nước uống), axit clohidric rất chất lượng được sử dụng để kiểm soát và điều chỉnh pH của nước cần xử lý. Trong ngành công nghiệp không yêu cầu độ tinh khiết cao, axit clohidric chất lượng công nghiệp chỉ việc đủ để trung hòa nước thải và xử lý nước hồ bơi.
e. Tái sinh bằng phương pháp trao đổi ion
Axit HCl rất chất lượng được sử dụng để tái sinh những nhựa trao đổi ion. Trao đổi cation được sử dụng rộng tự do để loại những ion như Na+ và Ca2+ từ những dung dịch chứa nước, tạo ra nước khử khoáng.
Trao đổi ion và nước khử khoáng được sử dụng trong toàn bộ những ngành công nghiệp hóa, sản xuất nước uống, và một số trong những ngành công nghiệp thực phẩm.
f. Trong sinh vật
Axit gastric là một trong những chất chính tiết ra từ dạ dày. Nó chứa hầu hết là axit clohidric và tạo môi trường tự nhiên vạn vật thiên nhiên axit trong dạ dày với pH từ là 1 đến 2.
Các ion Cl- và H+ được tiết ra riêng không liên quan gì đến nhau trong vùng đáy vị của dạ dày bởi những tế bào vách của niêm mạc dạ dày vào hệ tiết dịch gọi là tiểu quản trước lúc chúng đi vào lumen dạ dày.
Axit gastric giữ vai trò như một chất kháng lại ác vi sinh vật để ngăn ngừa nhiễm trùng và là yếu tố quan trọng để tiêu hóa thức ăn. pH dạ dày thấp làm biến tính những protein và do đó làm chúng dễ bị phân hủy bởi những enzym tiêu hóa như pepsin. Sau khi thoát khỏi dạ dày, axit clohydric của dịch sữa bị natri bicacbonat vô hiệu hóa trong tá tràng.
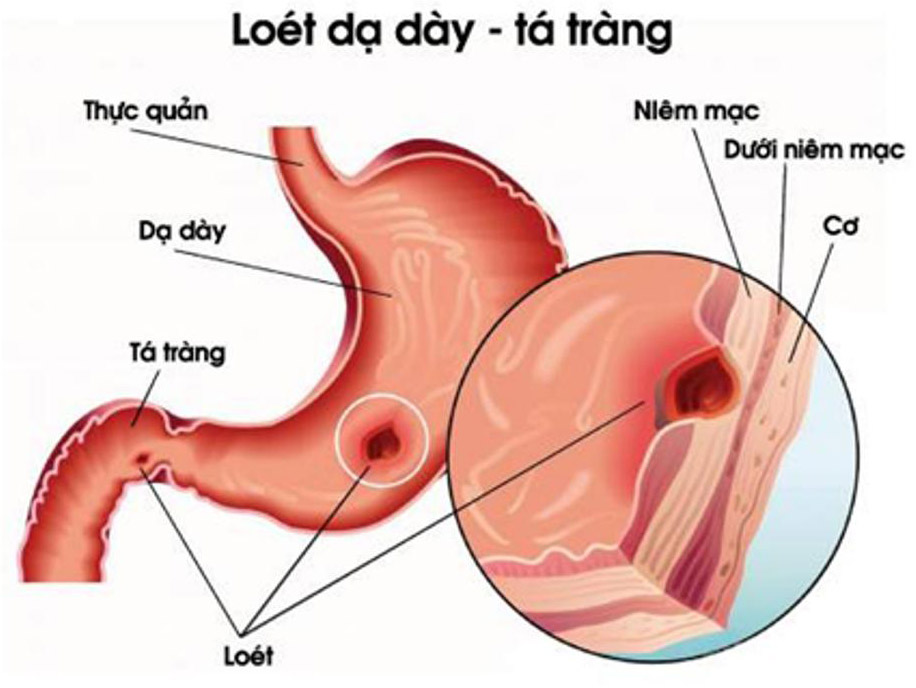
Axit gastric là một trong những chất chính tiết ra từ dạ dày. Nó chứa hầu hết là axit clohidric và tạo môi trường tự nhiên vạn vật thiên nhiên axit trong dạ dày với pH từ là 1 đến 2.
Dạ dày tự nó được bảo vệ khỏi axit mạnh bằng phương pháp tiết ra một lớp chất nhầy mỏng dính để bảo vệ, và bằng phương pháp tiết ra dịch tiết tố để tạo ra lớp đệm natri bicacbonat. Loét dạ dày hoàn toàn có thể xẩy ra khi những cơ chế này bị hỏng. Các thuốc nhóm kháng histamine và ức chế bơm proton (proton pump inhibitor) hoàn toàn có thể ức chế việc tiết axit trong dạ dày, và những chất kháng axit được sử dụng để trung hòa axit xuất hiện trong dạ dày.
Độc tính
Hydro clorua và axit clohidric đều phải có tính ăn mòn mắt, da và màng nhầy. Phơi nhiễm cấp tính (thời hạn ngắn) qua đường hô hấp hoàn toàn có thể gây kích ứng mắt, mũi và đường hô hấp, viêm và phù phổi ở người. Tiếp xúc cấp tính qua đường miệng hoàn toàn có thể gây ăn mòn màng nhầy, thực quản, dạ dày, và tiếp xúc qua da hoàn toàn có thể gây bỏng nặng, loét và để lại sẹo ở người.
Tiếp xúc nghề nghiệp lâu dài với axit clohydric sẽ gây nên ra viêm dạ dày, viêm phé quản mãn tính, viêm da và nhạy cảm với ánh sáng ở người lao động. Tiếc xúc lâu dài ở nồng độ thấp cũng hoàn toàn có thể gây ra sự đổi màu và mòn răng.

Nước là một hợp chất liên quan trực tiếp và rộng tự do đến việc sống trên Trái Đất, là cơ sở của yếu tố sống riêng với mọi sinh vật. Đối với toàn thế giới vô sinh, nước là một thành phần tham gia rộng tự do vào những phản ứng hóa học, nước là dung môi và là môi trường tự nhiên vạn vật thiên nhiên tàng trữ những Đk để thúc đẩy hay ngưng trệ những quy trình hóa học. Đối với con người nước là thành phần chiếm tỷ trọng lớn số 1.

Nước là một hợp chất liên quan trực tiếp và rộng tự do đến việc sống trên Trái Đất, là cơ sở của yếu tố sống riêng với mọi sinh vật
1. Tài nguyên nước và quy trình nước toàn thế giới
Trái Đất có tầm khoảng chừng 361 triệu km2 diện tích s quy hoạnh những đại dương (71% diện tích s quy hoạnh mặt phẳng Trái Đất). Trữ lượng tài nguyên nước có tầm khoảng chừng 1,5 tỉ km3, trong số đó nước trong nước chỉ chiếm khoảng chừng 91 triệu km3 (6,1%), còn 93,9% nước biển và đại dương. Tài nguyên nước ngọt chiếm 28,25 triệu km3 (1,88 % thủy quyển), nhưng phần lớn lại ở dạng ngừng hoạt động ở hai cực Trái Đất. Lượng nước thực tiễn con người hoàn toàn có thể sử dụng được 4,2 triệu km3 (0,28%) thủy quyển.
Các nguồn nước trong tự nhiên không ngừng nghỉ vận động và chuyển trạng thái (lỏng, khí, rắn) tạo ra vòng tuần hoàn nước trong sinh quyển: Nước bốc hơi, ngưng tụ và mưa. Nước vận chuyển trong những quyển, hòa tan và mang theo nhiều chất dinh dưỡng, chất khoáng và một số trong những chất thiết yếu cho đời sống của động và thực vật.

Chu trình tuần hoàn của nước
Nước ao, hồ, sông và đại dương… nhờ nguồn tích điện Mặt Trời bốc hơi vào khí quyển, hơi nước ngưng tụ lại rồi mưa rơi xuống mặt phẳng Trái Đất. Nước chu chuyển trong phạm vi toàn thế giới, tạo ra những cân đối nước và tham gia vào quy trình điều trung khí hậu Trái Đất. Hơi nước thoát từ những loài thực vật làm tăng nhiệt độ của không khí. Một phần nước mưa thấm qua đất thành nước ngầm, nước ngầm và nước mặt phẳng đều hướng ra phía biển để tuần hoàn trở lại, đó là quy trình nước. Tuy nhiên, lượng nước ngọt và nước mưa trên hành tinh phân loại không đều. Hiện nay, hàng trăm trên toàn toàn thế giới mới sử dụng khoảng chừng 4.000 km3 nước ngọt, chiếm khoảng chừng 40% lượng nước ngọt hoàn toàn có thể khai thác được.
2. Vai trò của nước
Nước ngọt là tài nguyên hoàn toàn có thể tái tạo nên, nhưng sử dụng phải cân đối giữa nguồn nước dự trữ và tái tạo. Sử dụng nên phải hợp lý nếu muốn cho việc sống tiếp nối lâu dài, vì hết nước thì môi trường tự nhiên vạn vật thiên nhiên sống đời thường của động – thực vật sẽ không còn tồn tại.
Trong Vũ trụ bát ngát chỉ có Trái Đất là có nước ở dạng lỏng, vì vậy giá trị của nước sau nhiều thập kỷ xem xét đã được nhìn nhận “Như dòng máu nuôi khung hình con người dưới một danh từ là máu sinh học của Trái Đất, do vậy nước quý hơn vàng”
Điều kiện hình thành đời sống thực vật phải có nước, nước đó đó là biểu lộ nơi muôn loài hoàn toàn có thể sống được, đó là giá trị đích thực của nước.
Môi trường nước không tồn tại cô lập với những môi trường tự nhiên vạn vật thiên nhiên khác, nó luôn tiếp xúc trực tiếp với không khí, đất và sinh quyển. Phản ứng hóa học trong môi trường tự nhiên vạn vật thiên nhiên nước có thật nhiều nét đặc trưng khi so sánh với cùng phản ứng đó trong phòng thí nghiệm hay trong sản xuất công nghiệp. Nguyên nhân của yếu tố khác lạ đó là tính không cân đối nhiệt động của hệ do tính “mở” tiếp xúc trực tiếp với khí quyển, thạch quyển, sinh quyển và số tạp chất trong nước cực kỳ phong phú. giữa chúng luôn có quy trình trao đổi chất, nguồn tích điện (nhiệt, quang, cơ năng), xẩy ra sôi động giữa mặt phẳng phân cách pha. Ngay trong tâm nước cũng xẩy ra những quy trình xa lạ với quy luật cân đối hóa học – quy trình giảm entropi, sự hình thành và tăng trưởng của những vi sinh vật.
a. Đời sống con người
Nước rất thiết yếu cho hoạt động và sinh hoạt giải trí sống của con người cũng như những sinh vật. Con người hoàn toàn có thể không ăn trong nhiều ngày mà vẫn sống, nhưng sẽ bị chết chỉ với sau ít ngày (khoảng chừng 3 ngày) nhịn khát, vì khung hình người dân có tầm khoảng chừng 65 – 86% nước, nếu mất 12% nước khung hình sẽ bị hôn mê và hoàn toàn có thể chết.
Để hoạt động và sinh hoạt giải trí thông thường, khung hình cần từ một đến bảy lít nước mỗi ngày để tránh mất nước; số lượng đúng chuẩn tùy từng mức độ hoạt động và sinh hoạt giải trí, nhiệt độ, nhiệt độ và những yếu tố khác. Hầu hết lượng này được tiêu hóa qua nhiều chủng loại thực phẩm hoặc đồ uống khác ngoài việc uống nước lọc. Theo Thương Hội Dinh dưỡng Anh khuyên rằng, riêng với một người khỏe mạnh thì nên khoảng chừng 2,5 lít tổng lượng nước mỗi ngày là mức tối thiểu để duy trì lượng nước thích hợp.

Mỗi ngày trung bình từng người cần khoảng chừng 2,5 đến 4 lít nước để phục vụ cho khung hình. Khi khung hình mất từ 10 đến 20 % lượng nước hoàn toàn có thể trong khung hình, động vật hoang dã hoàn toàn có thể chết.
Thận khỏe mạnh hoàn toàn có thể bài tiết từ 0,8 lít đến 1 lít nước mỗi giờ, nhưng căng thẳng mệt mỏi như tập thể dục hoàn toàn có thể làm giảm lượng nước này. Mọi người hoàn toàn có thể uống nhiều nước hơn mức thiết yếu trong lúc tập thể dục, khiến họ có rủi ro không mong muốn tiềm ẩn tiềm ẩn bị nhiễm độcnước hoàn toàn có thể gây tử vong.
Cụ thể, lượng nước thiết yếu dành riêng cho từng loại đối tượng người dùng như sau:
– Đàn ông tiêu thụ khoảng chừng 3 lít, phụ nữ là 2,2 lít
– Phụ nữ mang thai cần 2,4 lít và phụ nữ đang cho con bú cần uống khoảng chừng 3 lít chính bới một lượng lớn chất lỏng bị mất trong quy trình cho con bú.
Khoảng 20 % lượng nước nạp vào là từ thức ăn, trong lúc phần còn sót lại đến hơi thở. Khi gắng sức và tiếp xúc với nhiệt, lượng nước mất đi sẽ tăng thêm và nhu yếu chất lỏng hằng ngày cũng hoàn toàn có thể tăng thêm.
b. Công nghiệp và nông nghiệp
Nhu cầu nước cho sản xuất công nghiệp và nhất là nông nghiệp rất rộng. Để khai thác một tấn dầu mỏ nên phải có 10m3 nước, muốn sản xuất một tấn sợi tổng hợp nên phải có 5600 m3 nước, một TT nhiệt điện tân tiến với hiệu suất 1 triệu kW cần đến 1,2 – 1,6 tỉ m3 nước trong một năm.
Tóm lại, nước có một vai trò quan trọng không thể thiếu được cho việc sống tồn tại trên Trái Đất, là máu sinh học của Trái Đất nhưng nước cũng là nguồn gây tử vong cho một người, cho nhiều người và cả một hiệp hội to lớn. Vì vậy, nói tới nước là nói tới việc bảo vệ rừng, trồng rừng, tăng trưởng rừng để tái tạo lại nguồn nước, hạn chế cường độ dòng lũ lụt, để sử dụng nguồn nước làm thủy điện, để phục vụ nước sạch. Phải sử dụng hợp lý nước sinh hoạt và sản xuất khẩu đôi với việc chống ô nhiễm nguồn nước đã khai thác sử dụng, phải xử lý nước thải sản xuất và sinh hoạt.
3. Sự thật thú vị
– Khoảng 97% nước của Trái Đất là nước mặn (biển, đại dương), có hàm lượng muối cao, không thích hợp cho nhu yếu sinh hoạt của con người. Khoảng 2% nước thuộc dạng băng đá nằm ở vị trí hai cực Trái Đất. Chỉ có một% nước của Trái Đất kể trên được con người tiêu dùng, trong số đó: khoảng chừng 30% dùng cho mục tiêu tưới tiêu, 50% dùng cho những nhà máy sản xuất sản xuất nguồn tích điện, 7% dùng cho sinh hoạt và 12% dùng cho sản xuất công nghiệp.

Khoảng 97% nước của Trái Đất là nước mặn (biển, đại dương), có hàm lượng muối cao, không thích hợp cho nhu yếu sinh hoạt của con người.
– Nước mặt phẳng dễ bị ô nhiễm bởi hóa chất bảo vệ thực vật, phân bón, chất thải của con người và động vật hoang dã có trong nước thải sinh hoạt và nước thải công nghiệp.
– Bên cạnh đó, nước còn là một một trong những chỉ tiêu xác lập mức độ tăng trưởng của nền kinh tế thị trường tài chính xã hội. Thí dụ, để đã có được một tấn thành phầm thì lượng nước cần tiêu thụ như sau: than thì nên từ 3 đến 5 tấn nước; dầu mỏ từ 30 đến 50 tấn nước; giấy từ 200 – 300 tấn nước; gạo từ 5000 – 10000 tấn nước; thịt từ 20000 – 30000 tấn nước.
– Bạn có biết nước tinh khiết nhất ở trong vạn vật thiên nhiên là nước mưa và tuyết không? Nhưng chúng cũng chứa một số trong những khí tan được và những chất khác có ở trong khí quyển như O2, N2, CO2, những muối amoni nitrat, nitrit và cacbonat, những dấu vết của những chất hữu cơ, bụi.
– Nước ngầm là nước mưa rơi xuống mặt đất, thấm qua những lớp thấm nước như đất, cát đi đi học không thấm nước như đất sét sẽ tạo ra hồ nước ngầm. Thành phần của nước ngầm tùy từng những lớp đất mà nó trải qua và vào thời hạn nó tiếp xúc với những lớp đó.
– Nước sông chứa nhiều tạp chất và với lượng nhiều hơn nữa so với nước ngầm. Ngoài những khí tan được của khí quyển như O2, N2, CO2 trong nước sông còn tồn tại những muối carbonat, sulfat, chloride, của một số trong những sắt kẽm kim loại như calci, magie và natri, những chất hữu cơ, một ít chất vô cơ ở dạng lơ lửng.
CO2 (Cacbon dioxit )

Carbon dioxide được sử dụng trong ngành công nghiệp thực phẩm, công nghiệp dầu mỏ và công nghiệp hóa chất. Hợp chất này còn có nhiều mục tiêu sử dụng thương mại rất khác nhau nhưng một trong những ứng dụng lớn số 1 của nó như một chất hóa học là trong sản xuất đồ uống có ga; nó phục vụ sự lấp lánh trong đồ uống có ga như nước soda, bia và rượu vang sủi bọt.

Carbon dioxide được sử dụng trong ngành công nghiệp thực phẩm, công nghiệp dầu mỏ và công nghiệp hóa chất.
1. Ngành công nghiệp thực phẩm
Carbon dioxide là một chất phụ gia thực phẩm được sử dụng như một chất đẩy và chất kiểm soát và điều chỉnh độ chua trong ngành công nghiệp thực phẩm.
Bột nở sử dụng trong nhiều chủng loại bánh nướng tạo ra khí cacbonic làm cho khối bột bị phình to ra, do tạo ra những lỗ xốp chứa bọt khí. Men bánh mì tạo ra khí cacbonic bằng sự lên men trong khối bột, trong lúc nhiều chủng loại bột nở hóa học giải phóng ra khí cacbonic khi bị nung nóng hoaặc bị tác dụng với những axít.
Cacbon điôxít lỏng và rắn là chất làm lạnh quan trọng, nhất là trong công nghiệp thực phẩm, trong số đó chúng tham gia vào quy trình tàng trữ và vận chuyển nhiều chủng loại kem và những thực phẩm ướp đông.
Cacbon điôxít được sử dụng để sản xuất nước giải khát cacbonat hóa và nước sôđa. Theo truyền thống cuội nguồn, quy trình cacbonat hóa trong bia và vang nổ đã có được do lên men tự nhiên, nhưng một số trong những nhà sản xuất cacbonat hóa những đồ uống này một cách tự tạo.
2. Khí trơ
Cacbon điôxít thông thường cũng khá được sử dụng như thể khí điều áp rẻ tiền, không cháy. Các áo phao cứu trợ cứu hộ cứu nạn thông thường chứa những hộp nhỏ chứa cacbon điôxít đã nén để nhanh gọn thổi phồng lên. Các ống thép chứa cacbonic nén cũng khá được bán để cup cấp khí nén cho súng hơi, bi sơn, bơm lốp xe đạp điện, cũng như để làm nước khoáng xenxe.
Sự bốc hơi nhanh gọn của cacbon điôxít lỏng được sử dụng để gây nổ trong những mỏ than. Cacbon điôxít dập tắt lửa, và một số trong những bình cứu hỏa, nhất là nhiều chủng loại được thiết kể để dập cháy do điện, có chứa cacbon điôxít lỏng bị nén.
Cacbon điôxít cũng khá được sử dụng như thể môi trường tự nhiên vạn vật thiên nhiên khí cho công nghệ tiên tiến và phát triển hàn, tuy nhiên trong hồ quang thì nó phản ứng với phần lớn những sắt kẽm kim loại. Nó được sử dụng rộng tự do trong công nghiệp xe hơi tuy nhiên có chứng cứ đáng kể đã cho toàn bộ chúng ta biết khi hàn trong môi trường tự nhiên vạn vật thiên nhiên này thì mối hàn giòn hơn so với những mối hàn trong môi trường tự nhiên vạn vật thiên nhiên những khí trơ, và những mối hàn này theo thời hạn sẽ giảm phẩm cấp do sự tạo thành của axít cacbonic. Nó được sử dụng thao tác này hầu hết là vì nó rẻ tiền hơn nhiều so với những khí trơ như agon hay hêli.
3. Sản xuất dược phẩm và một số trong những ngành công nghiệp chế biến khác
Cacbon điôxít lỏng là một dung môi tốt cho nhiều hợp chất hữu cơ, và được sử dụng để vô hiệu cafêin từ cafe. Nó cũng khởi đầu nhận được sự để ý quan tâm của công nghiệp dược phẩm và một số trong những ngành công nghiệp chế biến hóa chất khác do nó là chất thay thế ít độc hơn cho những dung môi truyền thống cuội nguồn như những clorua hữu cơ.
4. Vai trò sinh học
Thực vật nên phải có cacbon điôxít để thực thi việc quang hợp, và những nhà kính hoàn toàn có thể được làm giàu bầu khí quyển của chúng bằng việc tương hỗ update CO2 nhằm mục đích kích thích sự tăng trưởng của thực vật. Người ta cũng đề xuất kiến nghị ý tưởng cho cacbon điôxít từ những nhà máy sản xuất nhiệt điện trải qua những ao để tăng trưởng tảo và tiếp theo đó chuyển hóa chúng thành nguồn nhiên liệu điêzen sinh học. Nồng độ cao của cacbon điôxít trong khí quyển tiêu diệt có hiệu suất cao nhiều loại sâu hại. Các nhà kính được nâng nồng độ CO2 tới 10.000 ppm (1%) trong vài giờ để tiêu diệt nhiều chủng loại sâu bệnh như rầy trắng (họ Aleyrodidae), nhện v.v.
Trong y học, tới 5% cacbon điôxít được thêm vào ôxy nguyên chất để trợ thở sau khi ngừng thở và để ổn định cân đối O2/CO2 trong máu.
Một dạng phổ cập của laser khí công nghiệp là laser cacbon điôxít, sử dụng cacbon điôxít làm môi trường tự nhiên vạn vật thiên nhiên. Cacbon điôxít cũng hay được bơm vào hay gần với những giếng dầu. Nó có tác dụng như thể tác nhân nén và khi hòa tan trong dầu thô dưới lòng đất thì nó làm giảm đáng kể độ nhớt của dầu thô, tạo Đk để dầu chảy nhanh hơn trong tâm đất vào những giếng hút. Trong những mỏ dầu đã hoàn thiện thì một khối mạng lưới hệ thống ống đồ sộ được sử dụng để chuyển cacbon điôxít tới những điểm bơm.
5. Băng khô
Băng khô là thương hiệu cho cacbon điôxít rắn (ngừng hoạt động). Làm lạnh thực phẩm, bộ sưu tập sinh học và những món đồ mau hỏng khác. Sản xuất “sương mù băng khô” để tạo những hiệu ứng đặc biệt quan trọng. Khi băng khô tiếp xúc với nước thì cacbon điôxít ngừng hoạt động thăng hoa thành hỗn hợp khí cacbon điôxít lạnh và không khí lạnh ẩm ướt. Điều này sinh ra sự ngưng tụ và hình thành sương mù; click more máy tạo sương mù.

Băng khô là thương hiệu cho cacbon điôxít rắn (ngừng hoạt động). Làm lạnh thực phẩm, bộ sưu tập sinh học và những món đồ mau hỏng khác.
Hiệu ứng sương mù của hỗn hợp băng khô với nước được tạo ra tốt nhất là với nước ấm. Các viên nhỏ băng khô (thay vì cát) được bắn vào mặt phẳng cần làm sạch. Băng khô không cứng như cát, nhưng nó tăng tốc quy trình bằng sự thăng hoa để “không hề gì” tồn tại trên mặt phẳng cần làm sạch và gần như thể không tạo ra nhiều bụi gây hại phổi. Tăng gây mưa từ những đám mây hay làm giảm độ dày của mây nhờ việc kết tinh nước trong mây. Sản xuất khí cacbon điôxít do thiết yếu trong những khối mạng lưới hệ thống như thùng nhiên liệu khối mạng lưới hệ thống trơ trong những máy bay B-47. Các ống lót trục bằng đồng đúc thau hay sắt kẽm kim loại khác được cho vào băng khô để làm chúng co lại sao cho chúng sẽ khớp với kích thước trong của lỗ trục. Khi những ống lót này ấm trở lại, chúng nở ra và trở nên cực kỳ khít nhau.
CaCl2 (Canxi diclorua )

Tác nhân hút ẩm: Do đặc tính hút ẩm mạnh mẽ và tự tin của nó, nên không khí hay nhiều chủng loại khí khác hoàn toàn có thể cho trải qua những ống chứa clorua canxi để vô hiệu hơi ẩm.
Canxi diclorua cũng khá được sử dụng như thể hợp chất làm tan băng do lượng nhiệt tỏa ra lớn trong quy trình hòa tan của nó
Nó cũng khá được sử dụng trong phối trộn bê tông nhằm mục đích tăng nhanh quy trình ổn định ban đầu của bê tông, tuy nhiên ion clorua lại dẫn tới sự ăn mòn của những thanh gia cố bằng thép, vì thế tránh việc sử dụng nó trong bê tông chịu lự
Một số ứng dụng công nghiệp khác gồm có sử dụng như thể phụ gia trong hóa dẻo, tương hỗ tiêu nước trong xử lý nước thải, chất tương hỗ update trong những thiết bị dập tắt vụ cháy bình cứu hỏa, phụ gia trong trấn áp tạo xỉ trong những lò cao, cũng như làm chất pha loãng trong nhiều chủng loại thuốc làm mềm vải.
Nó cũng khá được liệt kê như thể phụ gia thực phẩm được phép sử dụng với mã số là E509.
Canxi diclorua được sử dụng phổ cập như thể chất điện giải và có vị cực mặn, được tìm thấy trong nhiều chủng loại đồ uống dành riêng cho những người dân tập luyện thể thao và những dạng đồ uống khác, như Smartwater và nước đóng chai của Nestle.
Sinh học/Y học canxi diclorua phẩm cấp y tế hoàn toàn có thể tiêm vào đường ven để điều trị giảm canxi máu (thấp canxi huyết).
Share Link Down Phương trình ion rút gọn của CaSo3 + HCL miễn phí
Bạn vừa đọc tài liệu Với Một số hướng dẫn một cách rõ ràng hơn về Review Phương trình ion rút gọn của CaSo3 + HCL tiên tiến và phát triển nhất và Chia SẻLink Tải Phương trình ion rút gọn của CaSo3 + HCL miễn phí.

Thảo Luận vướng mắc về Phương trình ion rút gọn của CaSo3 + HCL
Nếu sau khi đọc nội dung bài viết Phương trình ion rút gọn của CaSo3 + HCL vẫn chưa hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Ad lý giải và hướng dẫn lại nha
#Phương #trình #ion #rút #gọn #của #CaSo3 #HCL